题目内容
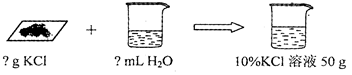
小强买来一包黄铜(铜、锌合金),包装说明如右图,他对包装说明上的质量分数产生了疑问,他称取20g黄铜样品放入烧杯中,然后往烧杯中加入稀硫酸93.7g,恰好完全反应,反应后称得烧杯内物质共113.5g.
(1)反应产生氢气______g.
(2)通过计算判断该黄铜样品中铜的质量分数是否与包装说明相符(计算结果精确到0.1%,下同).
(3)计算反应后所得溶液中溶质的质量分数是多少?

(1)反应产生氢气______g.
(2)通过计算判断该黄铜样品中铜的质量分数是否与包装说明相符(计算结果精确到0.1%,下同).
(3)计算反应后所得溶液中溶质的质量分数是多少?

(1)反应产生氢气=20g+93.7g-113.5g=0.2g
故答案为:0.2;
(2)设Zn质量为x,ZnSO4质量为y
Zn+H2SO4=ZnSO4+H2↑
65 1612
x y 0.2g
=
=
x=6.5g y=16.1g
黄铜样品中铜的质量分数=
×100%=67.5%
因为67.5%<70%,所以与包装说明不相符;
(3)反应后溶质质量分数=
×100%=16.1%
答:该黄铜样品中铜的质量分数与包装说明不相符;反应后所得溶液中溶质的质量分数是16.1%.
故答案为:0.2;
(2)设Zn质量为x,ZnSO4质量为y
Zn+H2SO4=ZnSO4+H2↑
65 1612
x y 0.2g
| 65 |
| x |
| 161 |
| y |
| 2 |
| 0.2 |
x=6.5g y=16.1g
黄铜样品中铜的质量分数=
| 20g-6.5g |
| 20g |
因为67.5%<70%,所以与包装说明不相符;
(3)反应后溶质质量分数=
| 16.1g |
| 113.5g-(20g-6.5g) |
答:该黄铜样品中铜的质量分数与包装说明不相符;反应后所得溶液中溶质的质量分数是16.1%.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目