题目内容
【题目】(8分)柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。下图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】:
①柠檬酸水溶液显酸性,柠檬酸钙不溶于水;
②工业生产柠檬酸,原料预处理后,得到的发酵液中
含有柠檬酸及其他可溶性杂质;
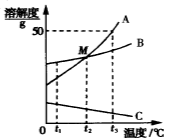
③一水柠檬酸在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
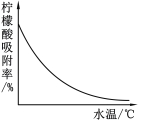
④某种专用树脂对柠檬酸的吸附率和水温的关系如右图:
【钙盐法制备】
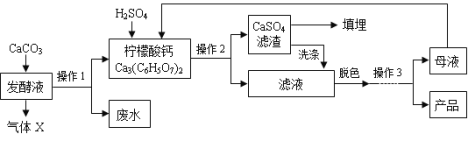
(1)气体X是 (填化学式),实验室检验该气体的化学方程式为 ;
(2)操作1、2的名称是 ;
(3)操作3的目的是得到一水柠檬酸晶体,操作顺序是b → → a;(填序号)
a.过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(4)工业生产中,可加入 (填序号)进行脱色处理;
A.活性炭 B.明矾 C.肥皂水
(5)洗涤CaSO4滤渣的目的是 ;
(6)母液可以循环,其中一定含有的溶质是 ;
【变温色谱分离法制备】
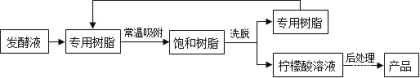
(7)对比“变温色谱分离法”,请你说出“钙盐法”的劣势 。
【答案】(1)CO2 CO2 +Ca(OH)2 ==CaCO3↓+ H20 (2)过滤 (3)C (4)A
(5)提高产量 (6)柠檬酸 (7) 消耗资源,破坏环境,“变温色谱分离法”降低了钙盐法中废水及CaSO4滤渣后期处理的费用,减少了CO2的排放
【解析】
试题分析:(1)气体X是CaCO3与发酵液中的柠檬酸反应而生成,为二氧化碳,化学式为:CO2,实验室检验该气体的方法是通入澄清石灰水中,看是否变浑浊,化学方程式为:CO2 +Ca(OH)2 ==CaCO3↓+ H20
(2)操作1、2是将不溶性固体与液体分离,名称是过滤
(3)操作3是制备一水柠檬酸晶体(C6H8O7·H2O),根据柠檬酸的溶解度随温度的变化情况,可以看出它的溶解度随温度的升高变化较大,故应采用降温结晶的方法,故应选C
(4)活性炭具有吸附性,故工业生产中,可加入活性炭进行脱色处理,故选A
(5)CaSO4滤渣上可能粘有柠檬酸(C6H8O7),故应用水清洗出来,这样可以提高产量
(6)因为是采用降温结晶的方法柠檬酸晶体,而即使在低温下柠檬酸的溶解度也不可能为0,故得到母液还一定含有柠檬酸
(7)根据“钙盐法”的流程图,可看出在生产过程中得到废水,而且需要的物质较多,这样消耗资源,破坏环境,同时“变温色谱分离法”降低了钙盐法中废水及CaSO4滤渣后期处理的费用,减少了CO2的排放