题目内容
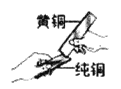
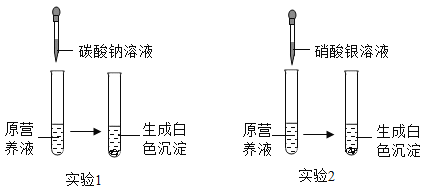
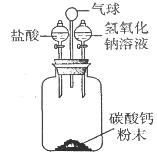
【题目】同学们做甲、乙两个中和反应实验的探究(见下图)。甲实验恰好中和,则该溶液中的溶质是![]() 。请仔细阅读,提取有用信息解答:
。请仔细阅读,提取有用信息解答:

(1)取乙反应后的溶液60.0g,滴加质量分数26.5%的![]() 溶液(见丙图),溶液pH的变化如图2所示。则与
溶液(见丙图),溶液pH的变化如图2所示。则与![]() 反应的碳酸钠溶液的质量为_____g;请计算该溶液中
反应的碳酸钠溶液的质量为_____g;请计算该溶液中![]() 的溶质质量分数_____(写出计算过程,精确到0.1%)。
的溶质质量分数_____(写出计算过程,精确到0.1%)。
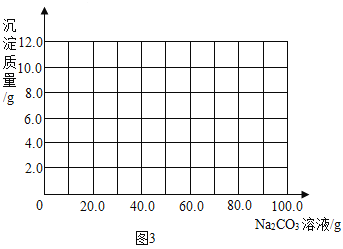
(2)根据计算所得数据在图3中画出产生沉淀的曲线_____;
(3)乙组的中和反应实验设计存在的不足是_____。
【答案】40.0 18.5% 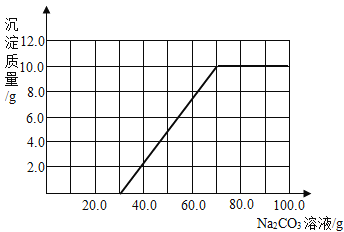 无法验证是否恰好中和
无法验证是否恰好中和
【解析】
(1)由图2可知,乙中稀盐酸过量,碳酸钠先和稀盐酸反应,当稀盐酸完全反应后,溶液pH=7,碳酸钠再和氯化钙反应生成碳酸钙沉淀和氯化钠,则与CaCl2反应的碳酸钠溶液的质量为:70.0g-30.0g=40.0g
(2)设:参加反应的CaCl2的质量为 x,生成的碳酸钙质量为y,则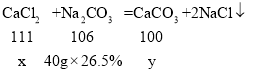
![]()
![]()
解得:x=11.1g x=10.0g;
该CaCl2溶液的溶质质量分数=![]() ;
;
(3)由图2可知乙反应后的溶液pH<7,说明溶液中仍有稀盐酸,直到滴加的Na2CO3溶液达到30.0g,稀盐酸被完全反应掉,Na2CO3溶液开始与CaCl2溶液反应,当滴加Na2CO3溶液到70.0g时,CaCl2溶液被完全反应掉。根据计算所得数据在图3中画出产生沉淀的曲线是:

(4)乙组的中和反应试验中没有加酚酞试液,无法验证是否恰好中和。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】如图中“一”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可转化为乙。下面四组选项中,符合如图要求的是( )
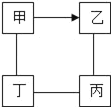
甲 | 乙 | 丙 | 丁 | |
A | H2SO4 | NaOH | NaCl | Na2CO3 |
B | CO | CO2 | H2SO4 | CuO |
C | Zn | ZnSO4 | Mg | HCl |
D | O2 | CO | CuO | C |
A. AB. BC. CD. D
【题目】过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源。Na2O2能和CO2反应生成O2和另一种固体化合物(用X表示)。
(提出猜想)有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是_____。
(设计方案)请完成下表。
实验步骤 | 实验现象 | 实验结论 |
实验一:取少量X,滴加稀盐酸,将产生的气体通入澄清石灰水。 | 有气泡产生;_____ | X为Na2CO3 |
实验二:取少量X,加水配成溶液,滴加碱的溶液,该碱可能是_____。 | 生成白色沉淀 |
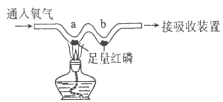
(拓展探究)用下图所示装置进行二氧化碳与过氧化钠(Na2O2)的反应。
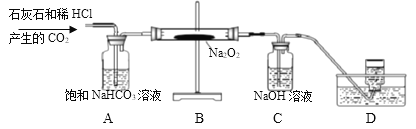
(1)装置A的作用是吸收CO2中混有的HCl,装置C中反应的化学方程是_____。
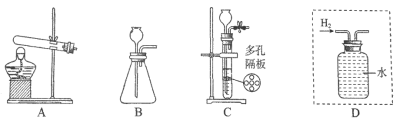
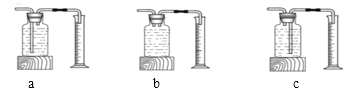
(2)测量装置D中收集的气体体积,可用下图中的_____进行收集。
(3)兴趣小组查阅资料发现Na2O2也能跟H2O反应生成NaOH和O2。为探究反应后装置B中固体的成分,甲同学取固体于试管中,加足量水,无气泡产生,则固体中一定没有_____。将所得溶液分成两份,进行下表所示实验:
实验操作 | 实验现象 | 分析与结论 |
向一份溶液中滴加过量的稀HCl | 有气泡产生 | B中固体有Na2CO3 |
向另一份溶液中_____ | 溶液变红 | B中固体有NaOH |
(定量计算)取充分反应后B中Na2CO3和NaOH混合物,投入200g7.3%的稀盐酸中恰好完全反应,称得反应后溶液的质量为234g,计算反应后所得溶液中溶质的质量分数。_____
(交流反思)若在装置A、B之间连接一个盛有_____的洗气瓶,完全反应后,装置B中的固体只有Na2CO3。