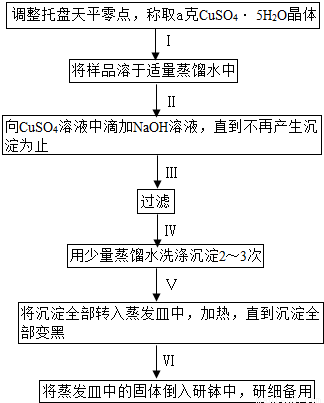
题目内容
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)将杂铜灼烧以除去其中的杂质,此过程中可能产生大量二氧化碳和少量一氧化碳。灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
a. 灼烧过程中部分氧化铜被还原
b. 灼烧不充分铜未被完全氧化
c. 氧化铜在加热过程中分解生成铜
d. 该条件下铜无法被氧气氧化
(2)由粗制氧化铜制取胆矾可以通过两种途径先得到硫酸铜溶液,进而得到胆矾。
途径Ⅰ的反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
途径Ⅱ的反应:2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、 。
(3)胆矾从物质类别上来说属于 (填“氧化物”“单质”“盐”“混合物”之一)
a b;产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体;盐

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目

 1调整天平零点时,若指针偏向左边,应将左边的平衡螺母向
1调整天平零点时,若指针偏向左边,应将左边的平衡螺母向

 CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和 _________ .
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和 _________ .

 CuSO4+SO2↑+2H2O.从环保和经济的角度对比分析途径I、II,途径I的优点有:不产生有害气体和______.
CuSO4+SO2↑+2H2O.从环保和经济的角度对比分析途径I、II,途径I的优点有:不产生有害气体和______.