题目内容
【题目】甲、乙两种固体物质的溶解度曲线如下图一所示:
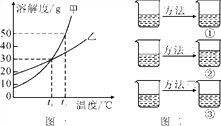
(1)t1 ℃时甲物质的溶解度是____;乙物质的溶解度随温度的升高而____(填“增大”或“减小”)。
(2)将45 g的甲物质分成三等份,分别加入各盛有100 mL水的三只烧杯中,形成t1 ℃时甲的不饱和溶液。如上图二所示,再分别通过蒸发溶剂,增加溶质和降低温度三种方法中的一种,将它们都变成甲的饱和溶液。此时烧杯②中溶液质量最大,烧杯③中溶液质量最小,则方法一是_____。
(3)若向烧杯②饱和溶液中加入少量的乙物质,溶液质量____(填“不变”“增大”或“无法确定”)。
【答案】 30 g 增大 降低温度 增大
【解析】(1)通过分析溶解度曲线可知,t1℃时,甲物质的溶解度是30g,乙物质的溶解度随温度的升高而增大;
(2)将甲的不饱和溶液变为饱和溶液,可采取蒸发溶剂、增加溶质和降低温度三种方法,其中溶质质量最大的是采取加入溶质的方法,蒸发溶剂溶液的质量减少,所以烧杯②中溶液质量最大,烧杯③中的溶液质量最小,烧杯③中总量减少,说明采取了蒸发溶剂、且析出了晶体的方法,①是采取了降温至恰好饱和的方法,因为降温溶质、溶剂质量不变,故方法一是降低温度;
(3)若向烧杯②饱和溶液中再加入少量的乙物质,溶液质量会增大,因为该饱和溶液是甲的饱和溶液,不是乙的饱和溶液,所以加入乙会继续溶解。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
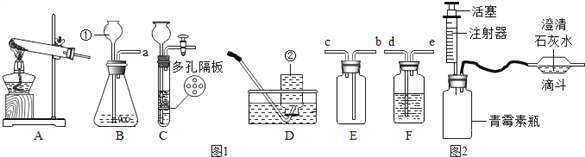
一线名师口算应用题天天练一本全系列答案【题目】某研究小组对自动充气气球(示意图如图1)进行下列探究.
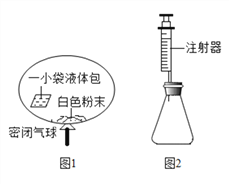
【查阅资料】该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为了检验气体是二氧化碳,可选用____(填试剂名称),反应方程式为_______________。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈_____性。
探究二:白色粉末成分的探究
【猜想与假设】
甲同学认为是碳酸钙; 乙同学认为是碳酸钠; 丙同学认为是碳酸氢钠。
【设计并进行实验】
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明________同学的猜想不正确。
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 5 | V1 |
② | 碳酸钠 | 5 | V2 |
③ | 白色粉末 | x | V1 |
实验①的化学方程式为__________;表中x=_____;V1 ____V2(填“>”、“<”或“=”)。
【分析并得出结论】:
(5)白色粉末是_________。