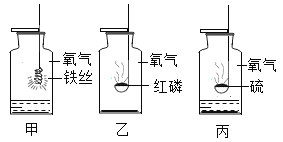
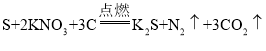题目内容
【题目】规范的实验操作是安全地进行实验并获得成功的重要保证。请回答:
(1)从细口瓶中倾倒液体时,标签一定要向着手心的原因是____________。
(2)为了节约药品,实验时取用药品要取最少量,一般液体取_____,固体只需_________。
(3)使用量筒正确读数的方法是视线与__________________。当视线仰视时读数为38mL,其正确的体积数应_______(填“大于”“小于”或“等于”)38mL。
(4)给液体加热时,液体的体积不可超过试管容积的_____,使用酒精的______焰加热。
【答案】防止淌下来的药品腐蚀标签 1mL~2mL 盖满试管底部 凹液面的最低处保持水平 大于 ![]() 外
外
【解析】
(1)从细口瓶中倾倒液体时,标签一定要向着手心的原因是防止淌下来的药品腐蚀标签;
(2)为了节约药品,实验时取用药品要取最少量,一般液体取1mL~2mL,固体只需盖满试管底部。
(3)使用量筒正确读数的方法是视线与凹液面的最低处保持水平。当视线仰视时读数为38mL,其正确的体积数应大于38mL。
(4)给液体加热时,液体的体积不可超过试管容积的![]() ,酒精灯的外焰温度最高,应该使用酒精的外焰加热。
,酒精灯的外焰温度最高,应该使用酒精的外焰加热。

 暑假作业暑假快乐练西安出版社系列答案
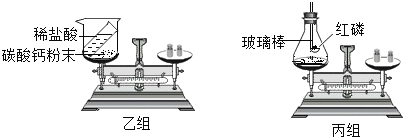
暑假作业暑假快乐练西安出版社系列答案【题目】如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
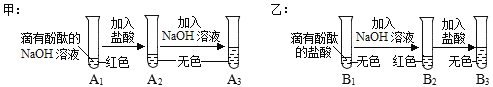
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据上图实验,请你与甲、乙同学一起完成下列探究:
探究环节 | 甲同学的探究 | 乙同学的探究 |
提出问题 | A3溶液为什么不变红? | B3溶液中溶质成分是什么?(酚酞不计) |
作出猜想 | 实验过程中,酚酞变质了。 | 猜想一:NaCl 猜想二:NaCl、HCl |
实验验证 | (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想_________(填“成立”或“不成立”)。 | (2)取少量B3溶液加入盛有少量锌粉的试管中,观察到有无色气泡产生,固体逐渐减少。据此,你认为乙同学的猜想________(填“一”或“二”)成立。 |
交流反思 | (1)甲、乙同学的实验中,反应均涉及到的化学方程式是________________ (2)A3溶液未变红,你认为原因是A2溶液中____________较多,加入的NaOH溶液未将其完全中和。 (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意__________的控制。 | |
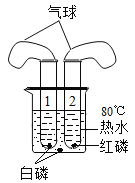
【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,小明同学想:
Ⅰ、氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究:
(猜想)a 氧化铜不是催化剂,也不参与反应,反应前后质量和化学性质不变。
b 氧化铜参与反应,反应前后质量和化学性质发生了改变。
c 氧化铜是反应的催化剂,反应前后_________________________。
(实验)用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,实验过程如下:
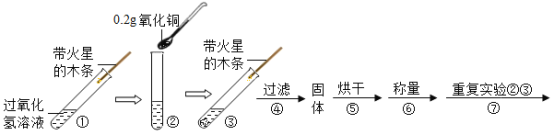
(1)步骤③现象是试管内有____________放出,带火星木条复燃;步骤⑥的结果是________。
(2)步骤⑦的现象是溶液中有大量气泡产生,带火星木条______;由此可得出结论;猜想c成立。
(3)步骤①的目的是_________________________________________。
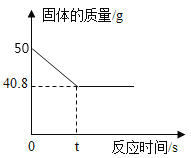
Ⅱ、以下是小明同学探究影响反应速率部分因素的相关实验数据。
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/mL | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/mL | 反应所需的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 1 | 35 | 2 | 49.21 | |
④ | 30 | 1 | 55 | 2 | 10.76 |
(4)通过实验①和②对比可知,化学反应速率与_________________有关;从实验③和④对比可知,化学反应速率与温度的关系是___________________;
(5)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量_________________(选填“减小”或“不变”或“增大”)