题目内容
【题目】皮革作为重要的工业产品由生皮鞣制成,在这一过程中需要添加重铬酸钾。重铬酸钾在加热时分解,反应的方程式为:4K2Cr2O7![]() 4K2Cr2O4+2X+3O2↑.
4K2Cr2O4+2X+3O2↑.
(1)写出X的化学式__________,K2Cr2O7的相对分子质量为__________;
(2)这一反应能否用于实验室制取氧气?__________(填能或不能),原因是__________________;
(3)如下图为铬元素在元素周期表中的信息:
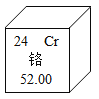
铬原子的核外电子数是_______,原子核的中子数为______。
【答案】O3 294 不能 有臭氧生成使氧气不纯 24 28
【解析】
(1)依据质量守恒定律可知:重铬酸钾在加热时分解,反应的方程式为:4K2Cr2O7![]() 4K2Cr2O4+2O3↑+3O2↑,则X的化学式:O3;K2Cr2O7的相对分子质量为:39×2+52×2+16×7=294;
4K2Cr2O4+2O3↑+3O2↑,则X的化学式:O3;K2Cr2O7的相对分子质量为:39×2+52×2+16×7=294;
(2)重铬酸钾在加热时分解同时产生氧气和臭氧两种气体,会导致收集氧气不纯,不能用于实验室制氧气;
(3)由元素周期表图例可知:铬原子的核外电子数=原子序数=质子数=核电荷数=24,中子数-相对原子质量-质子数=52-24=28。

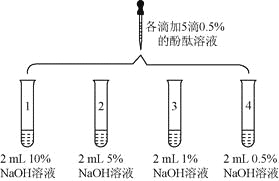
【题目】(6分)众所周知,酚酞溶液遇![]() 溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
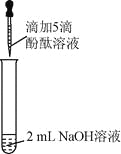
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与![]() 溶液和空气中的
溶液和空气中的![]() 反应有关。
反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
实验 | 实验操作 | 实验现象 | |
1 | 向盛有2 mL | 溶液变红 | |
2 |
| 1号试管 | |
3 | 取3支试管,分别加入2 mL水,…… | 酚酞溶液浓度/% | 浑浊程度] |
5 | 大量浑浊物 | ||
2 | 少量浑浊物 | ||
| 无浑浊物 | ||
【解释与结论】
(1)![]() 与
与![]() 反应的化学方程式为 。
反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设1/span> (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入![]() 水, 。
水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为![]() ,建议选用NaOH溶液的浓度为 %。
,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
【题目】小俊在实验室测定空气中氧气的含量。
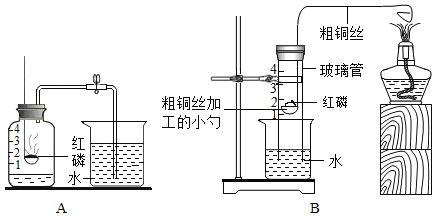
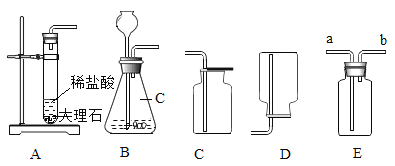
(1)小俊利用图A所示装置实验时,取下橡胶塞,点燃红磷迅速伸入集气瓶中并塞紧橡胶塞,打开止水夹前看到的现象是____________,涉及到化学方程式为_____________;
(2)在实验室中小俊发现了如下图B所示的改进装置,并在装置的使用说明上阅读到了白磷和红磷的相关知识:
红磷 | 紫红或略带棕色的固体 | 难溶于水,密度比水大 | 200℃以上着火(约260℃) | 燃烧时产生白烟,烟有毒。化学性质比白磷差,在常温下稳定,难与氧反应。 |
白磷 | 白色或浅黄色半透明性固体。 | 不溶于水,密度比水大 | 在湿空气中约30℃着火,在干燥空气中则稍高。 | 有毒。人的手温就容易使白磷燃烧,所以取用时必须用镊子,存放多在冷水中。 |
①B装置的优点是_____________(只写一点);
②装置中粗铜丝的作用是___________;
③从理论上分析,玻璃管内液面最终将上升至___________处(填1、2、3、4);
④在老师的协助下,小俊用B装置也做了测定了空气中氧气的含量,发现实验测结果液面偏低,其原因可能是__________。