题目内容
【题目】海水素有“液体工业原料”之美誉。工业“从海水中提取镁”的主要流程如下:
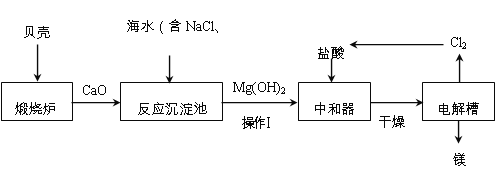
(1)煅烧炉中,发生反应的化学方程式为:CaCO3![]() CaO+CO2↑,此反应属于基本类型中的______反应。
CaO+CO2↑,此反应属于基本类型中的______反应。
(2)反应沉淀池中发生如下反应:
①CaO+H2O=Ca(OH)2;
②Ca(OH)2+ MgSO4= CaSO4 + Mg(OH)2↓,
操作Ⅰ为_________。
(3)电解槽中,能生成镁的反应物为____________。
(4)从海水中提取镁的过程中,镁元素的化合价变化为__________。
【答案】分解过滤MgCl2(或氯化镁) +2变为0
【解析】
(1)该反应是一种物质生成两种物质的分解反应;(2)操作Ⅰ是分离不溶性固体和液体的方法,是过滤操作;(3)电解槽中,能生成镁的反应物为氯化镁,化学式为:MgCl2;(4)氯化镁中镁元素是+2价,生成的镁中镁元素是0价。

练习册系列答案
相关题目
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
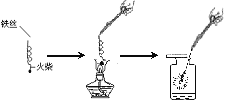
A 木炭燃烧 | B铁丝燃烧 |
(1)木炭在氧气中燃烧时,可观察到的实验现象为______________________。 (2)若验证生成物,需向集气瓶中加入的药品为_________________。 |
(1)铁丝在氧气中燃烧的化学方程式为_______。 (2)实验时,预先在集气瓶里装少量水的作用是_________________________。 |