题目内容
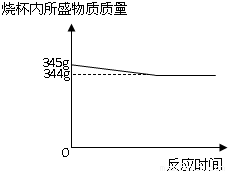
黄铜是常见的合金.为了测定某黄铜(成分为铜和锌)中锌的质量分数,某化学兴趣小组的同学进行了以下实验:取100g黄铜的样品,粉碎后加入装有245g足量稀硫酸的烧杯中,反应过程中测得烧杯内所盛物质的质量与相应时间记录如图:请回答下列问题并计算:
(1)样品与稀硫酸反应生成的气体是______,质量为______g.
(2)计算样品中锌的质量分数(写出具体计算过程,精确到0.1%)
【答案】分析:(1)锌能与稀硫酸反应生成氢气,而铜不能,故依据图象中反应前后物质的质量之差可求生成的氢气质量;
(2)依据氢气的质量利用化学方程式可求混合物中锌的质量,进而可求样品中锌的质量分数;
解答:解:(1)锌的金属活动性在氢前铜在氢后所以锌能与稀硫酸反应生成氢气,其质量为345g-344g=1g;
(2)解:设100g样品中锌的质量为x:
Zn+H2SO4=ZnSO4+H2↑
65 2
x 1g
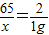
x=32.5g
样品中锌的质量分数为: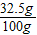 ×100%=32.5%
×100%=32.5%
故答案为:(1)H2; 1;(2)答:样品中锌的质量分数为32.5%.
点评:利用质量守恒定律求出反应放出氢气的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.
(2)依据氢气的质量利用化学方程式可求混合物中锌的质量,进而可求样品中锌的质量分数;
解答:解:(1)锌的金属活动性在氢前铜在氢后所以锌能与稀硫酸反应生成氢气,其质量为345g-344g=1g;
(2)解:设100g样品中锌的质量为x:
Zn+H2SO4=ZnSO4+H2↑
65 2
x 1g
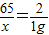
x=32.5g
样品中锌的质量分数为:
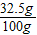 ×100%=32.5%
×100%=32.5%故答案为:(1)H2; 1;(2)答:样品中锌的质量分数为32.5%.
点评:利用质量守恒定律求出反应放出氢气的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
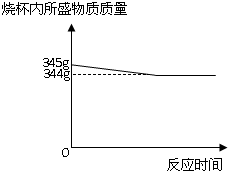 黄铜是常见的合金.为了测定某黄铜(成分为铜和锌)中锌的质量分数,某化学兴趣小组的同学进行了以下实验:取100g黄铜的样品,粉碎后加入装有245g足量稀硫酸的烧杯中,反应过程中测得烧杯内所盛物质的质量与相应时间记录如图:
黄铜是常见的合金.为了测定某黄铜(成分为铜和锌)中锌的质量分数,某化学兴趣小组的同学进行了以下实验:取100g黄铜的样品,粉碎后加入装有245g足量稀硫酸的烧杯中,反应过程中测得烧杯内所盛物质的质量与相应时间记录如图: