题目内容
【题目】生活、生产、环保等都离不开化学。我们学习了化学知识后,观察物质世界就要从化学视角看。
(1)(6分)节假日,某班同学去郊外进行野炊活动。请回答下列问题。
①他们所带的下列物品中,主要材料属于合成高分子材料的是 。(填序号)
A.纯净水 B.棉布围裙 C.铁锅铁铲 D.塑料凳子
②学生野炊食谱如下:主食:馒头;配菜:红烧肉、豆腐汤、牛肉干和黄瓜.你认为食谱中的馒头主要为人体补充的营养素是 。
③加碘食盐中的“碘”是指碘 。(填“原子”或“分子”或“元素”)
④洗涤剂可用来洗碗,是因为它对油污具有 功能。
⑤在引燃细枯枝后,如果迅速往“灶”里塞满枯枝,结果反而燃烧不旺,并产生很多浓烟,其原因是 。
⑥若不小心被蚊虫叮咬(蚊虫能分泌出蚁酸),可用下列物质之一涂抹以减轻疼痛,该物质是 。(填序号)
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
(2)(5分)水是生命之源,也是人类最宝贵的资源。试用你学过的化学知识,回答下列问题。
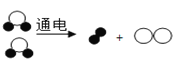
①下图是水分子的电解模型图,根据质量守恒定律可判断该模型图中缺少了 。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
②欲判断得到的生活用水是硬水还是软水,可加入 进行检验,生活中常通过 的方法降低水的硬度。
③水是最重要的溶剂,可以配制不同的溶液。
Ⅰ.20℃时,NaCl 的溶解度是36 g。该温度下,饱和食盐水中溶质与溶剂的质量比为 ;
Ⅱ.某氢氧化钾溶液中,平均每100个水分子中溶有1个钾离子。则这种溶液中氢氧化钾的质量分数约为 。(精确到0.1%)
【答案】(1)①D;②糖类;③元素;④乳化;⑤迅速往“灶”里塞满枯枝,进入的空气少,可燃物与氧气的接触面积小了,燃烧会不充分;⑥C;(2)①B;②肥皂水,煮沸;③Ⅰ9:25;Ⅱ3.0%.
【解析】
①塑料属于合成有机合成高分子材料,棉布属于天然材料,铁锅铁铲属于金属材料,水属于天然材料;
②馒头中富含糖类;
③碘盐中的“碘”指的是元素;
④洗涤剂有乳化作用,能将大的油滴分散成细小的油滴随水冲走;
⑤燃烧不旺,主要是空气浓度小,燃料太多,与空气不能充分接触,发生了不完全燃烧,所以物质要充分燃烧的条件是必须与氧气充分接触;
⑥A、食醋的pH小于7,呈酸性,故A错误;
B、食盐水的pH等于7,呈中性,故B错误;
C、肥皂水的pH大于7,呈碱性,故C正确.
(2)①由于水的电解的方程式是:2H2O![]() 2H2↑+O2↑,由水分子的结构可知
2H2↑+O2↑,由水分子的结构可知![]() 代表氢原子,
代表氢原子,![]() 代表氧原子,故
代表氧原子,故![]() 代表氢气分子,
代表氢气分子,![]() 代表氧气分子,所以根据质量守恒定律可判断该模型图中缺少了
代表氧气分子,所以根据质量守恒定律可判断该模型图中缺少了![]() .②欲判断得到的生活用水是硬水还是软水,可加入 肥皂水进行检验,生活中常通过 煮沸的方法降低水的硬度.
.②欲判断得到的生活用水是硬水还是软水,可加入 肥皂水进行检验,生活中常通过 煮沸的方法降低水的硬度.
③Ⅰ.20℃时,NaCl的溶解度是36g.是指该温度下100g水中最多溶解36g氯化钠,所以饱和食盐水中溶质与溶剂的质量比=36:100=9:25;
Ⅱ.某氢氧化钾溶液中,根据“平均每100个水分子中溶有1个钾离子”,而1个氢氧化钾分子(相对分子质量为39+16+1=56)电离出1个钾离子,则这种溶液中氢氧化钾的质量分数约为![]() ×100%≈3%.
×100%≈3%.

 第1卷单元月考期中期末系列答案
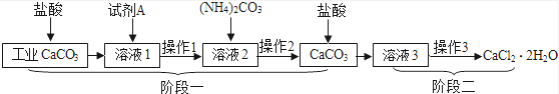
第1卷单元月考期中期末系列答案【题目】碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
Ⅰ、吕布兰法
1789年,法国医生吕布兰(N.Leblanc,1742—1806)以食盐、浓硫酸,木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如下:

(1)碳酸钠俗称______。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为______。
(3)③中“水浸”时通常需要搅拌,其目的是______。
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处______。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
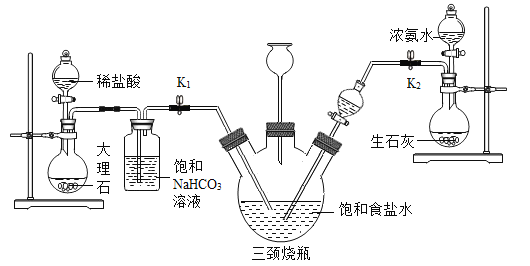
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______。
(6)三颈烧瓶上连接的长颈漏斗的主要作用是______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通一段时间
CO2,其目的是______。
(7)根据实验记录,计算t2时NaHCO3固体的分解率______(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程。若加热前NaHCO3固体中还存在少量NaCl,上述计算结果将_____(填“偏大”、“偏小”或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布于众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的候氏制碱法。下列认识或理解正确的是______。
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的作用率,它符合当今“绿色化学”的理念。
【题目】英国科学家法拉第曾为少年儿童做过一个有趣的“母子火焰”实验,如图所示。回答下列有关问题。
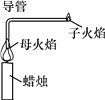
(1)子火焰的可燃物是________,蜡烛能产生母子火焰这一现象是由组成蜡烛的物质的重要物理性质决定的,该物理性质是______________________________。
(2)该实验成功的关键是导气管不宜太长,且导气管的起端必须插在蜡烛母火焰的中心部位,原因是:
①_______________________________________________;
②_______________________________________________。
(3)若蜡烛的主要成分是石蜡,则其燃烧的反应文字表达式为:_____________。
(4)某研究小组由法拉第的实验又联想到:在学习氧气的化学性质时发现:铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
①写出铁丝在氧气中燃烧的文字表达式_______________________________________
②探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如下图所示)。由此可知:蜡烛燃烧产生的火焰是由____________(填“固态”或“气态”)物质燃烧形成的。

③探究二:物质燃烧产生火焰的根本原因是什么? __________________________
(查阅资料)
物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
石蜡 | 50∽70 | 300∽550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其____________(填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰____________________________。由此推测:钠在燃烧时,________(填“有”或“没有”)火焰产生。
④ 根据硫在空气或氧气中燃烧的实验事实,请你推测硫沸点______硫燃烧时的温度(填“>”或“<”或“=”)