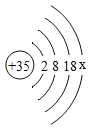
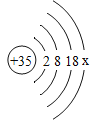
题目内容
【题目】某中学化学课外活动小组对某工厂排放的含少量硫酸的废水进行抽样检测。取一定量的废水,用质量分数为1%的氢氧化钡溶液与之反应(其它物质不与氢氧化钡反应),当恰好完全反应时,消耗氢氧化钡溶液的质量为171g,过滤后,测得滤液的质量为268.67g。(不考虑过滤时滤液质量损失)(计算结果保留二位小数)(温馨提示:氢氧化钡与硫酸反应的化学方程式为:Ba(OH)2+ H2SO4= BaSO4↓ + 2H2O)求:
⑴反生成沉淀的质量为多少?
⑵该工厂排放的废水中所含硫酸的溶质的质量分数为多少?
【答案】解:①设生成沉淀的质量为x
H2SO4+Ba(OH)2═BaSO4↓+2H2O
98 171 233
y 171g×1% x
![]()
x=2.33g
②所取废水样品质量=(268.67+2.33)g﹣171g=100g
设废水样品中所含硫酸质量为y
![]()
y=0.98g
该工厂排放的废水中硫酸的质量分数=0.98g ÷100g×100%=0.98%
答:①反应中生成沉淀的质量为2.33g;
②该工厂排放的废水中所含硫酸的质量分数为0.98%.
【解析】
解:①设生成沉淀的质量为x
H2SO4+Ba(OH)2═BaSO4↓+2H2O
98 171 233
y 171g×1% x
![]()
x=2.33g
②据质量守恒定律可知反应前后物质的总质量不变,所取废水样品质量=(268.67+2.33)g﹣171g=100g
设废水样品中所含硫酸质量为y
![]()
y=0.98g
该工厂排放的废水中硫酸的质量分数=0.98g ÷100g×100%=0.98%
答:①反应中生成沉淀的质量为2.33g;
②该工厂排放的废水中所含硫酸的质量分数为0.98%.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】如图所示,超市的洗涤用品区域有一种叫做“污渍爆炸盐”的新型洗涤剂,能清除衣服上难以清洗的黄斑、血渍、奶渍等。某化学兴趣小组的同学对“污渍爆炸盐”与水作用后的产物进行了探究。

(1)查阅资料:“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4),它是白色结晶颗粒,与水作用会产生碳酸盐和其他化合物。
(2)小明猜想其他化合物为:Ⅰ.NaOH;Ⅱ.H2O2;Ⅲ.NaOH和H2O2,小明作出以上猜想的理论依据是_____。
(3)实验设计:探究“污渍爆炸盐”水溶液的成分完成下列表格。
实验步骤 | 实验现象 | 实验结论 |
步骤1:取少量“污渍爆炸盐”于烧杯中,加入足 量蒸馏水,充分搅拌。 | 固体完全溶解,形成无色溶液 | / |
步骤2:取少量步骤1形成的溶液于试管中,再加入足量氯化钙溶液。 | _____ | 含有Na2CO3 |
步骤3:取少量步骤2试管中的上层清液于另一支 试管中,再滴加少量MgCl2溶液,振荡。 | 无明显现象 | _____ |
步骤4:另取一支试管,加入少量步骤1形成的溶 液,再加入少量二氧化锰,将带火星木条伸入试管中。 | 带火星的木条复燃 | 含有H2O2 |
(4)实验结论:猜想Ⅱ正确。
写出过碳酸钠与水反应的化学方程式_____。