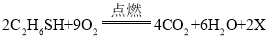题目内容
【题目】某化学兴越小组为了测定某石灰石样品中碳酸钙的含量,进行了如下实验:取25.0g石灰石样品粉碎后放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。求:
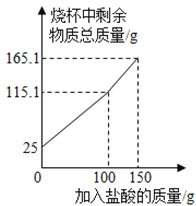
(1)产生CO2的总质量为_____g。
(2)石灰石样品中碳酸钙的质量分数_____(写出计算过程)。
【答案】9.9 90%
【解析】
(1)由质量守恒定律可知,反应前后物质的总质量不变,产生二氧化碳的质量为:25g+100g-115.1g= 9.9g;
(2)设石灰石样品中碳酸钙的质量是x,则:
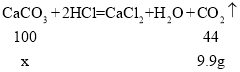
![]()
![]()
石灰石样品中碳酸钙的质量分数=![]() ;
;
答:(1)产生 CO2的总质量为9.9g;(2)石灰石样品中碳酸钙的质量分数为90%。

【题目】“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究.

(提出问题)锌与硫酸反应的快慢受哪些因素的影响呢?
(猜想与假设)a可能与硫酸的质量分数有关;b可能与锌的形状有关.
(设计并实验)小兵用不同质量分数的硫酸和不同形状的锌进行如下实验.
实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
① | 30% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 20% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式______.
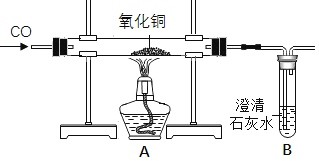
(2)小兵用如图装置收集并测量氢气的体积,其中量筒的作用是______,氢气应从______(填e或f或g)管通入.
(3)若用该收集CO2,并测量生成的CO2气体的体积,其中在水面上放一层植物油目的是______;
(收集证据)(4)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是______.
(得出结论)(5)结论是______
(评价与反思)(6)下表是小兵第①组实验的详细数据.
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因______.
(7)锌与硫酸反应的快慢可能还受哪些因素影响?_____设计实验验证.______.
【题目】下表是几种原子或分子的示意图,根据图示的反应历程判断,下列说法错误的是( )
图例 |
|
|
|
|
|
|
|
|
原子或分子 | 1个A原子 | 1个B原子 | 1个C原子 | 1个D原子 | 1个AD2分子 | 1个B2分子 | 1个BD2分子 | 1个CB分子 |
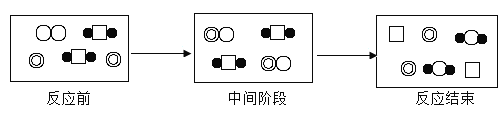
A.该反应是置换反应B.反应中间阶段发生了化合反应
C.反应结束阶段发生了复分解反应D.物质C是反应的催化剂
【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
[查阅资料]铁的活动性比铜强。
[进行猜想]对三种金属的活动性顺序做出如下猜想:
猜想一: R>Fe>Cu;
猜想二:_____
猜想三: Fe>Cu>R
[收集证据]为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | _____ | 猜想一正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R 丝表面产生气泡速率比铁丝表面产生气泡速率_____(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R 丝在空气中剧烈燃烧,铁丝在空气中不燃烧 |
写出铁丝与稀盐酸反应的化学方程式_____。
[交流反思]三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
[归纳总结]他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与_____是否反应。