题目内容
“飞秒化学”为科学家阿?泽韦尔赢得了1999年诺贝尔化学奖.应用“飞秒化学”技术,犹如电视节目通过慢动作来观看足球精彩镜头一样,可以让我们通过慢动作观察处于化学反应过程的原子与分子转变状态.比如该技术能够清晰展现冰箱中致冷剂氟里昂(CCl2F2)破坏大气臭氧层所发生的化学反应的全过程(反应历程):
①O3
O2+O ②
其总反应方程式为 2O3
3O2,已知CCl2F2
CClF2+Cl,氯原子在破坏臭氧的过程中生成ClO,ClO遇氧原子又产生Cl,故对臭氧层可产生长久的破坏作用.试补充完整该反应历程.
①O3
| ||
Cl+O3=ClO+O2
Cl+O3=ClO+O2
;③ClO+O=Cl+O2
ClO+O=Cl+O2
.其总反应方程式为 2O3
| ||
| ||
分析:根据题意可知,氯原子和臭氧分子结合生成ClO,ClO遇氧原子又产生Cl.
解答:解:氯原子和臭氧分子结合生成ClO,ClO遇氧原子又产生Cl.化学反应的全过程:①O3
O2+O;②Cl+O3=ClO+O2;③ClO+O=Cl+O2.
故答案为:②Cl+O3=ClO+O2;③ClO+O=Cl+O2.
| ||
故答案为:②Cl+O3=ClO+O2;③ClO+O=Cl+O2.
点评:要认真阅读材料,结合物理知识用材料内容回答问题,在中考中出现在频率较高.

练习册系列答案
相关题目
 O2+O ②______;③______.
O2+O ②______;③______.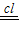 3O2,已知CCl2F2
3O2,已知CCl2F2 CClF2+Cl,氯原子在破坏臭氧的过程中生成ClO,ClO遇氧原子又产生Cl,故对臭氧层可产生长久的破坏作用.试补充完整该反应历程.
CClF2+Cl,氯原子在破坏臭氧的过程中生成ClO,ClO遇氧原子又产生Cl,故对臭氧层可产生长久的破坏作用.试补充完整该反应历程. O2+O ②______;③______.
O2+O ②______;③______. 3O2,已知CCl2F2
3O2,已知CCl2F2 CClF2+Cl,氯原子在破坏臭氧的过程中生成ClO,ClO遇氧原子又产生Cl,故对臭氧层可产生长久的破坏作用.试补充完整该反应历程.
CClF2+Cl,氯原子在破坏臭氧的过程中生成ClO,ClO遇氧原子又产生Cl,故对臭氧层可产生长久的破坏作用.试补充完整该反应历程. O2+O
O2+O  3O2,已知CCl2F2
3O2,已知CCl2F2 CClF2+Cl,氯原子在破坏臭氧的过程中生成ClO,ClO遇氧原子又产生Cl,故对臭氧层可产生长久的破坏作用.试将上述反应历程补充完整.
CClF2+Cl,氯原子在破坏臭氧的过程中生成ClO,ClO遇氧原子又产生Cl,故对臭氧层可产生长久的破坏作用.试将上述反应历程补充完整.