题目内容
【题目】金属是一类重要的材料,其应用十分广泛.
(1)生活中常用铁锅炒菜,主要利用了铁具有(填序号).
A.导热性
B.导电性
C.金属光泽
(2)铁制品生锈是铁与共同作用的结果,写出防止铁制品生锈的一种方法;
(3)如图1,向一定量AgSO3溶液中加入铜、锌的混合粉末,充分反应后过滤,得到溶液甲和固体乙:
①若乙中含有锌、铜、银三种金属,则溶液甲中所含金属离子的符号为 , 此时向固体乙中加入稀盐酸,发生反应的化学方程式为 .
②若溶液甲是蓝色,是因为(用化学方程式表示),此时固体乙中一定含有的物质是 .
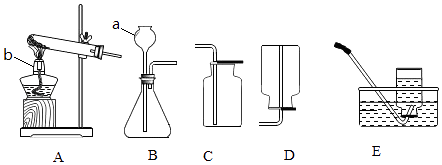
(4)某小组同学用一氧化碳还原氧化铁的实验测定某赤铁矿中氧化铁的质量分数,取10.0g赤铁矿样品按如图2装置实验,测的实验室前、后B装置(包含集气瓶内物质)的质量分别为112.3g和118.9g,请计算该赤铁矿中氧化铁的质量分数.
【答案】
(1)A
(2)氧气、水;在铁制品表面涂油或刷油漆
(3)Zn2+;Zn+2HCl═ZnCl2+H2↑;Cu+2AgNO3═2Ag+Cu(NO3)2;银
(4)
测定实验数据,澄清石灰水增重6.6g,可知石灰水增重是因吸收了二氧化碳的质量,即二氧化碳的质量为6.6g,
设10.0g样品中氧化铁的质量为x,则
Fe2O3 +3CO ![]() 2Fe+3CO2,
2Fe+3CO2,
160 132
x 6.6g
![]()
x=8g
即10.0g样品中含有氧化铁的质量为8.0g,
样品中氧化铁的质量分数为: ![]() ×100%=80%
×100%=80%
所以铁矿石中氧化铁的质量分数是80%.
【解析】解:(1)铁锅炒菜是利用铁锅能将煤气燃烧放出的热量传递给菜,利用了铁的导热性;故填:A;(2)钢铁生锈是铁与氧气、水共同作用的结果;由铁生锈的条件可知防止铁生锈的措施有:在铁制品表面涂油或刷油漆等;故填:氧气、水,在铁制品表面涂油或刷油漆;(3)在金属活动顺序表中,金属的活动性顺序是锌>铜>银.向一定量AgNO3溶液中加入铜和锌的混合粉末时,锌先与硝酸银反应,当锌反应完后,铜再与硝酸银反应.
①若乙中含有锌、铜、银三种固体,说明了溶液中没有硝酸银、硝酸铜,则溶液甲中所含的金属离子符号为:Zn2+ , 此时向固体乙中加入稀盐酸,锌能与发生反应,化学方程式为:Zn+2HCl═ZnCl2+H2↑,该反应是一种单质与一种化合物反应生成了另一种单质和另一种化合物,属于置换反应;
②若溶液甲显蓝色,说明了铜与于硝酸银反应生成了硝酸铜,化学方程式为:Cu+2AgNO3═2Ag+Cu(NO3)2 , 此时固体乙中一定含有的物质是银.
所以答案是:①Zn2+ , Zn+2HCl═ZnCl2+H2↑;
②Cu+2AgNO3═2Ag+Cu(NO3)2 , 银;
4)测定实验数据,澄清石灰水增重6.6g,可知石灰水增重是因吸收了二氧化碳的质量,即二氧化碳的质量为6.6g,
设10.0g样品中氧化铁的质量为x,则
Fe2O3 +3CO ![]() 2Fe+3CO2 ,
2Fe+3CO2 ,
160 132
x 6.6g![]()
x=8g
即10.0g样品中含有氧化铁的质量为8.0g,
样品中氧化铁的质量分数为: ![]() ×100%=80%
×100%=80%
所以铁矿石中氧化铁的质量分数是80%.
【考点精析】根据题目的已知条件,利用金属的物理性质及用途和金属材料的选择依据的相关知识可以得到问题的答案,需要掌握金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽.(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.