题目内容
【题目】请结合下列实验常用装置,回答有关问题: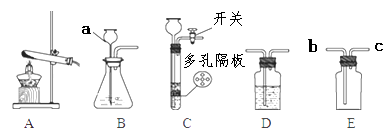
(1)写出有关标号仪器的名称a
(2)实验室制取CO2的方程式为 , 若要获得干燥的二氧化碳,还应选用D装置,并在该装置中盛放(填写试剂名称)。如果用E装置收集该气体,则气体从端进入(填“b”或“c”)。
(3)实验室若用块状固体和液体无需加热制取气体,可将B装置改进为C装置(多孔隔板用来放块状固体),其改进后的优点是。
(4)工业上以氨气为原料制备硝酸的过程(见图1)如下: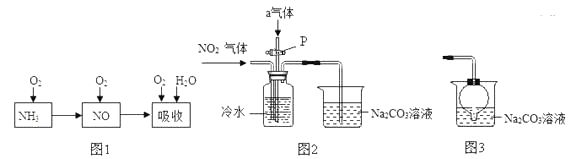
某课外小组认真分析了工业制取硝酸的流程及反应原理,设计了如图2的实验装置制备硝酸,试回答下列相关问题:
①完成图1工业上用氨气制取NO的化学方程式:4NH3+5O2═4NO+6;然后产生的NO被氧气氧化成NO2;NO2和水反应生成硝酸和NO。
②连接好图2装置后,首先进行的操作是。
③图2中通入的气体a是 , 其目的是。
④盛有Na2CO3溶液的烧杯作为尾气处理装置有点缺陷,某兴趣小组把图2右边装置改进成如图3的装置,这样改进的优点是。
【答案】
(1)长颈漏斗
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑,浓硫酸,b
(3)控制反应的发生与停止
(4)H2O,检查装置的气密性,氧气,提高NO2的转化率,防止倒吸或者充分吸收有害气体 。
【解析】(1)a是长颈漏斗;
(2)实验室制取CO2常用碳酸钙和稀盐酸即方程式 CaCO3+2HCl=CaCl2+H2O+CO2↑,用浓硫酸干燥;CO2的密度比空气大,应从b进入;
(3)控制反应的发生与停止;
(4)依据质量守恒定律为① H2O ;②连接好图2装置后,首先进行的操作是检查装置的气密性;③图2中通入的气体a是氧气,其目的是提高NO2的转化率;④改进的优点是防止倒吸或者充分吸收有害气体.
所以答案是:(1)长颈漏斗;
(2) CaCO3+2HCl=CaCl2+H2O+CO2↑;浓硫酸;b;(3)可随时控制反应的发生与停止;
(4)①H2O;检查装置的气密性;氧气;提高NO2的转化率;防止倒吸或者充分吸收有害气体.
【考点精析】解答此题的关键在于理解质量守恒定律及其应用的相关知识,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.
