题目内容
【题目】如图所示,①、②分别是钠元素、氯元素在元素周期表中的信息,A,B,C,D是四种粒子的结构示图. 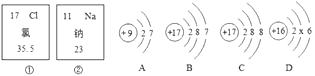
试回答下列问题:
(1)氯元素的相对原子质量为 , 钠元素的原子序数(即质子数)为;
(2)D中x= , D元素的原子在化学变化中比较容易(选填“得”或“失”)电子,该元素属于(选填“金属”或“非金属”)元素.
(3)B和属于同种元素的不同粒子(填“A”“C”或“D”).
(4)A和B两种粒子的相同,所以他们具有相似的化学性质.
(5)钠原子和氯原子反应所形成的化合物是由(填“原子”、“分子”或“离子”)构成的.
【答案】
(1)35.5;11
(2)8;得;非金属
(3)C
(4)最外层电子数
(5)离子
【解析】解:(1)由元素周期表中的一格中获取的信息可知,钠元素的原子序数为11;氯的相对原子质量为35.5.故填:35.5;11;(2)在原子中,质子数=核外电子数,所以x=16﹣2﹣6=8;其最外层有6个电子,在化学反应中易得到电子,16号元素硫元素属于非金属元素;故填:8;得;非金属;(3)B和C具有相同的核电荷数,属于同种元素,故填:C;(4)决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质,由于A、B的最外层电子数均为7,故具有相似的化学性质;故填:最外层电子数;(5)钠原子和氯原子反应所形成的化合物氯化钠是由钠离子和氯离子构成的,故填:离子.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目