题目内容
为研究化学反应前后反应物与生成物之间的质量关系,三位同学分别做了如下实验:
实验一:称取镁条,点燃,待反应结束后,再称量;
实验二:将盛有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,充分反应(锌+稀盐酸→硫酸锌+氢气)后再称量.
实验三:将盛有氢氧化钠溶液的试管放入盛有硫酸溶液的烧杯中,称量,然后设法使两种溶液混合,充分反应后再称量.2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
三位同学的实验数据如下:
(1)从实验数据上看,这三个实验中,化学反应前后物质的总质量是实验一:
(2)在三个实验中,实验
(3)由此可得出结论:用实验研究化学反应前后反应物与生成物之间的质量关系时,必须在
实验一:称取镁条,点燃,待反应结束后,再称量;
实验二:将盛有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,充分反应(锌+稀盐酸→硫酸锌+氢气)后再称量.
实验三:将盛有氢氧化钠溶液的试管放入盛有硫酸溶液的烧杯中,称量,然后设法使两种溶液混合,充分反应后再称量.2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
三位同学的实验数据如下:
| 实验编号 | 实验一 | 实验二 | 实验三 |
| 反应前 | 4.8g | 112.4g | 118.4g |
| 反应后 | 8.0g | 110.4g | 118.4g |
增大
增大
,实验二:减小
减小
,实验三:不变
不变
(填“增大”、“减小”、“不变”)(2)在三个实验中,实验
三
三
正确地反映了反应物与生成物之间的质量关系,造成其它二个实验结果错误的原因分别是实验一反应前的质量总和还应包括参加反应的氧气的质量,实验二测定的生成物质量中少了另一种生成物氢气的质量
实验一反应前的质量总和还应包括参加反应的氧气的质量,实验二测定的生成物质量中少了另一种生成物氢气的质量
.(3)由此可得出结论:用实验研究化学反应前后反应物与生成物之间的质量关系时,必须在
封闭
封闭
体系中进行.分析:质量守恒定律是指参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和.要探究质量守恒定律,在比较反应前后的质量关系时,不可漏掉任何一种反应物或生成物.镁燃烧的实验中,参加反应的镁与氧气质量之和等于生成的氧化镁的质量,而实验一只称量了反应物镁的质量而没有称量参加反应的氧气的质量,从而导致实验数据增大.实验二中生成物有两种:氯化锌和氢气,参加反应的锌与盐酸质量之和等于生成的氯化锌和氢气的质量之和,而称量时漏掉了氢气的质量,导致数据减小.任何化学反应都应遵循质量守恒定律.为保证探究实验的成功,应在密闭容器中进行.
解答:解:(1)实验一中,参加反应的镁的质量+参加反应的氧气的质量=生成的氧化镁的质量,而实验中没有称量反应物氧气的质量,从而导致反应后质量增大;实验二中,参加反应的锌的质量+参加反应的盐酸的质量=氯化锌的质量+氢气的质量,而实验中没有称量产生的氢气的质量,从而导致结果减小.实验三中,没有气体的参与与产生,故反应前后数值相等.
(2)从表中可以看出,只有实验三反应前后数值相等;任何化学反应都遵循质量守恒定律,导致结果不守恒的原因是:实验一中漏掉了其中的反应物氧气,实验二中漏掉了生成物氢气,只比较了部分反应物或生成物的质量,所以从数值上得不出正确结论.
(3)用实验研究化学反应前后反应物与生成物之间的质量关系时,要比较反应前后的“质量总和”,必须保证不能遗漏任何一种反应物与生成物,特别是有气体参与或生成的反应,故在密闭容器中实验是最可靠的.
故答案为:(1)增大;减小;不变;(2)三;实验一反应前的质量总和还应包括参加反应的氧气的质量,实验二测定的生成物质量中少了另一种生成物氢气的质量;(3)封闭.
(2)从表中可以看出,只有实验三反应前后数值相等;任何化学反应都遵循质量守恒定律,导致结果不守恒的原因是:实验一中漏掉了其中的反应物氧气,实验二中漏掉了生成物氢气,只比较了部分反应物或生成物的质量,所以从数值上得不出正确结论.
(3)用实验研究化学反应前后反应物与生成物之间的质量关系时,要比较反应前后的“质量总和”,必须保证不能遗漏任何一种反应物与生成物,特别是有气体参与或生成的反应,故在密闭容器中实验是最可靠的.
故答案为:(1)增大;减小;不变;(2)三;实验一反应前的质量总和还应包括参加反应的氧气的质量,实验二测定的生成物质量中少了另一种生成物氢气的质量;(3)封闭.
点评:该题考查的是质量守恒定律的探究,实质是考查对质量守恒定律定义的理解,通常考查其中的“参加”、“质量总和”等,在作答时要找全反应物及生成物.

练习册系列答案
相关题目
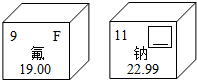 元素周期表是学习和研究化学的重要工具,根据下列信息回答问题:
元素周期表是学习和研究化学的重要工具,根据下列信息回答问题:(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是
(2)下表是部分元素的原子结构示意图、主要化合价等信息
| 第二周期 | 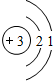 Li Li |
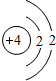 Be Be |
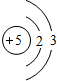 B B |
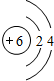 C C |
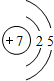 N N |
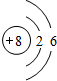 O O |
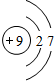 F F |
| 主要 化合价 |
+1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 | 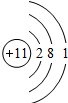 Na Na |
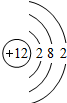 Mg Mg |
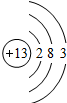 Al Al |
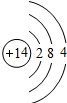 Si Si |
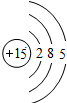 P P |
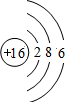 S S |
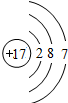 Cl Cl |
| 主要 化合价 |
+1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
②写出由原子序数为12和17的元素组成化合物的化学式
③上表中各元素的最高正化合价与原子最外层电子数的关系是
④右图形象地表示了某化学反应前后分子的变化.其中“
 ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原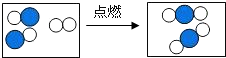 子序数为6的原子,则该反:
子序数为6的原子,则该反: 元素周期表是学习和研究化学的重要工具,根据下列信息回答问题:
元素周期表是学习和研究化学的重要工具,根据下列信息回答问题:
(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是________;钠元素属于________(填“金属”、“非金属”或“稀有气体”)元素.氟元素的相对原子质量是________;
(2)下表是部分元素的原子结构示意图、主要化合价等信息
| 第二周期 | 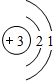 Li Li | 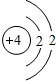 Be Be | 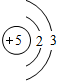 B B | 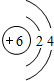 C C |  N N | 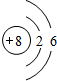 O O |  F F |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 |  Na Na | 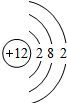 Mg Mg |  Al Al |  Si Si | 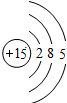 P P |  S S | 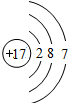 Cl Cl |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
②写出由原子序数为12和17的元素组成化合物的化学式________;
③上表中各元素的最高正化合价与原子最外层电子数的关系是________(填“相等”或“不相等”).
④右图形象地表示了某化学反应前后分子的变化.其中“
 ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原 子序数为6的原子,则该反:________.
子序数为6的原子,则该反:________.
元素周期表是学习和研究化学的重要工具,根据下列信息回答问题:
(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是______;钠元素属于______(填“金属”、“非金属”或“稀有气体”)元素.氟元素的相对原子质量是______;
(2)下表是部分元素的原子结构示意图、主要化合价等信息
氩原子的质子数是18,请画出氩原子的原子结构示意图______;
②写出由原子序数为12和17的元素组成化合物的化学式______;
③上表中各元素的最高正化合价与原子最外层电子数的关系是______(填“相等”或“不相等”).
④右图形象地表示了某化学反应前后分子的变化.其中“ ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原 子序数为6的原子,则该反:______ 2CO2
子序数为6的原子,则该反:______ 2CO2

(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是______;钠元素属于______(填“金属”、“非金属”或“稀有气体”)元素.氟元素的相对原子质量是______;
(2)下表是部分元素的原子结构示意图、主要化合价等信息
| 第二周期 |  Li Li |  Be Be |  B B | 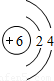 C C | 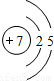 N N | 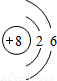 O O | 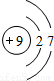 F F |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 | 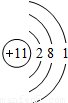 Na Na | 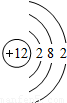 Mg Mg | 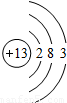 Al Al | 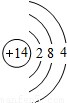 Si Si |  P P |  S S |  Cl Cl |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
②写出由原子序数为12和17的元素组成化合物的化学式______;
③上表中各元素的最高正化合价与原子最外层电子数的关系是______(填“相等”或“不相等”).
④右图形象地表示了某化学反应前后分子的变化.其中“
 ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原 子序数为6的原子,则该反:______ 2CO2
子序数为6的原子,则该反:______ 2CO2
元素周期表是学习和研究化学的重要工具,根据下列信息回答问题:
(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是______;钠元素属于______(填“金属”、“非金属”或“稀有气体”)元素.氟元素的相对原子质量是______;
(2)下表是部分元素的原子结构示意图、主要化合价等信息
氩原子的质子数是18,请画出氩原子的原子结构示意图______;
②写出由原子序数为12和17的元素组成化合物的化学式______;
③上表中各元素的最高正化合价与原子最外层电子数的关系是______(填“相等”或“不相等”).
④右图形象地表示了某化学反应前后分子的变化.其中“ ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原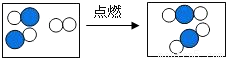 子序数为6的原子,则该反:______ 2CO2
子序数为6的原子,则该反:______ 2CO2
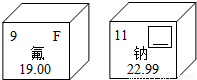
(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是______;钠元素属于______(填“金属”、“非金属”或“稀有气体”)元素.氟元素的相对原子质量是______;
(2)下表是部分元素的原子结构示意图、主要化合价等信息
| 第二周期 | 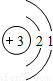 Li Li | 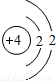 Be Be |  B B | 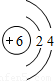 C C | 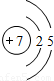 N N | 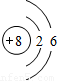 O O | 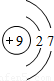 F F |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 | 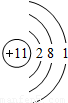 Na Na | 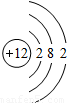 Mg Mg | 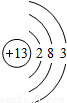 Al Al | 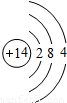 Si Si | 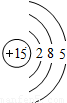 P P | 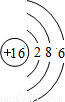 S S | 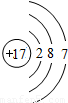 Cl Cl |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
②写出由原子序数为12和17的元素组成化合物的化学式______;
③上表中各元素的最高正化合价与原子最外层电子数的关系是______(填“相等”或“不相等”).
④右图形象地表示了某化学反应前后分子的变化.其中“
 ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原 子序数为6的原子,则该反:______ 2CO2
子序数为6的原子,则该反:______ 2CO2
元素周期表是学习和研究化学的重要工具,根据下列信息回答问题:
(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是______;钠元素属于______(填“金属”、“非金属”或“稀有气体”)元素.氟元素的相对原子质量是______;
(2)下表是部分元素的原子结构示意图、主要化合价等信息
氩原子的质子数是18,请画出氩原子的原子结构示意图______;
②写出由原子序数为12和17的元素组成化合物的化学式______;
③上表中各元素的最高正化合价与原子最外层电子数的关系是______(填“相等”或“不相等”).
④右图形象地表示了某化学反应前后分子的变化.其中“ ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原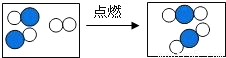 子序数为6的原子,则该反:______ 2CO2
子序数为6的原子,则该反:______ 2CO2
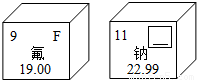
(1)右图是两种元素在元素周期表中的信息,其中方框的横线上填的是______;钠元素属于______(填“金属”、“非金属”或“稀有气体”)元素.氟元素的相对原子质量是______;
(2)下表是部分元素的原子结构示意图、主要化合价等信息
| 第二周期 |  Li Li |  Be Be | 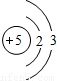 B B |  C C | 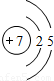 N N |  O O |  F F |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 | 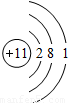 Na Na |  Mg Mg | 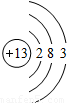 Al Al | 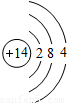 Si Si |  P P |  S S |  Cl Cl |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
②写出由原子序数为12和17的元素组成化合物的化学式______;
③上表中各元素的最高正化合价与原子最外层电子数的关系是______(填“相等”或“不相等”).
④右图形象地表示了某化学反应前后分子的变化.其中“
 ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原
”表示原 子序数为6的原子,则该反:______ 2CO2
子序数为6的原子,则该反:______ 2CO2