题目内容
如图所示,装置A中盛有氯化氢气体,装置C、D、E、F、G中分别盛有五种不同的溶液,H为一根两端开口的玻璃管,分液漏斗中盛有NaOH的饱和溶液,B装置中的圆底烧瓶内壁预先用酚酞试液浸润,K为开口很小的尖端玻璃管.根据下列操作顺序,回答下列问题: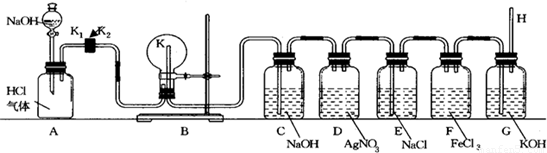
(1)打开分液漏斗的旋塞K1,关闭旋塞K2,稍等片刻,关闭旋塞K1,打开旋塞K2,此时在B装置中可观察到的实验现象是______.
(2)按要求完成下表
| 实验装置编号 | 实 验 现 象 | 化学方程式 |
| D瓶 | ||
| F瓶 |
【答案】分析:由于氢氧化钠与氯化氢反应而使A瓶气压减小,与外界气压形成压强差,在压强差的作用下将液体由G到C依次压入相邻瓶内.
解答:解:氢氧化钠与氢化氢气体反应生成氯化钠和水,A瓶气压减小,外界大气压将G瓶中压入F瓶,氢氧化钾溶液与氯化铁溶液反应生成氢氧化铁红褐色沉淀,F中的氯化铁溶液被压入E中,E中氯化钠溶液压入D中,与D中硝酸银溶液反应生成氯化银白色沉淀,D中硝酸银压入C中,C中氢氧化钠溶液压入B中形成喷泉,氢氧化钠溶液能使酚酞试液变红,从而使红色的液体压入A瓶中.
故答案为:(1)形成喷泉,液体变红色;
(2)
点评:本题关健分析出A瓶气压减小,整套组合装置是连通着的,液体从右到左依次流入.
解答:解:氢氧化钠与氢化氢气体反应生成氯化钠和水,A瓶气压减小,外界大气压将G瓶中压入F瓶,氢氧化钾溶液与氯化铁溶液反应生成氢氧化铁红褐色沉淀,F中的氯化铁溶液被压入E中,E中氯化钠溶液压入D中,与D中硝酸银溶液反应生成氯化银白色沉淀,D中硝酸银压入C中,C中氢氧化钠溶液压入B中形成喷泉,氢氧化钠溶液能使酚酞试液变红,从而使红色的液体压入A瓶中.
故答案为:(1)形成喷泉,液体变红色;
(2)
| 实验装置编号 | 实验现象 | 化学方程式 |
| D瓶 | 有白色沉淀生成 | AgNO3+NaCl=AgCl↓+NaNO3 |
| F瓶 | 有红褐色沉淀生成 | FeCl3+3KOH=Fe(OH)3↓+3KCl |
点评:本题关健分析出A瓶气压减小,整套组合装置是连通着的,液体从右到左依次流入.

练习册系列答案
相关题目
 孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.
孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.冶炼铜的反应原理为:Cu(OH)2CO3
| ||
2CuO+C
| ||
某校课外小组同学在实验室验证上述反应.
(1)加热分解碱式碳酸铜,生成氧化铜.装置如下图所示.
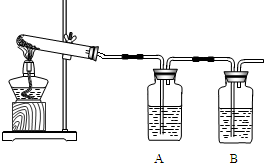
①瓶A中盛有的试剂是
②瓶B中盛有的试剂是澄清石灰水,用来
③反应结束,熄灭酒精灯前,应
(2)木炭和氧化铜反应,生成铜.
将木炭粉末和氧化铜粉末混合均匀,放进试管,加热充分反应.将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余.该小组同学设计方案验证黑色粉末的成分.
查阅资料:部分内容如下:木炭和氧化铜都是黑色粉末.氧化铜与稀硫酸反应生成硫酸铜,木炭与稀硫酸不反应.
| 操作和药品 | 现象 | 分析和结论 | |
| 方案Ⅰ | 取少量剩余黑色粉末,充分灼烧 | ①______________ ________________ |
原剩余黑色粉末是 氧化铜 |
| 方案Ⅱ | ②_______________ __________________ |
③_____________ _________________ |
原剩余黑色粉末是 氧化铜 |
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比.设计方案如下:
| 配方1 | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
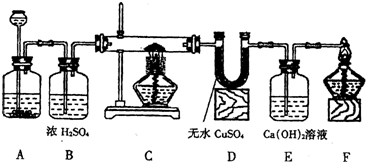 (2005?内蒙古)如图所示,装置A中放有的固体物质可能是碳酸镁或锌粒或丽者的混合物,装置C玻璃管内盛有的黑色粉末可能是炭粉或氧化铜或丽者的混合物,从长颈漏斗中加入稀硫酸,过一会儿点燃酒精灯.请回答下列问题.
(2005?内蒙古)如图所示,装置A中放有的固体物质可能是碳酸镁或锌粒或丽者的混合物,装置C玻璃管内盛有的黑色粉末可能是炭粉或氧化铜或丽者的混合物,从长颈漏斗中加入稀硫酸,过一会儿点燃酒精灯.请回答下列问题.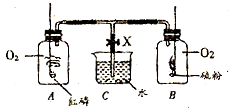 如图所示,装置A、B的燃烧匙中分别装红磷和硫粉,集气瓶A和B中原来均集满了氧气,C中盛有水,X为止水夹.分别点燃红磷和硫粉,使之在A、B两瓶中充分燃烧(红磷和硫粉均为足量,X关闭着).当反应完成并冷却至室温后打开止水夹,看到的现象是( )
如图所示,装置A、B的燃烧匙中分别装红磷和硫粉,集气瓶A和B中原来均集满了氧气,C中盛有水,X为止水夹.分别点燃红磷和硫粉,使之在A、B两瓶中充分燃烧(红磷和硫粉均为足量,X关闭着).当反应完成并冷却至室温后打开止水夹,看到的现象是( )