题目内容
【题目】(5分)粉煤灰是一种火山灰质材料,来源于煤中的无机组成,从粉煤灰中能够获得Al2O3,已知某火力发电厂的粉煤灰中的化学成分如下表:

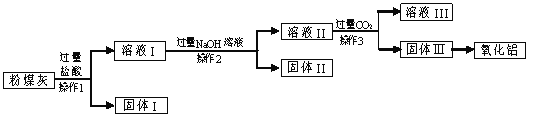
上述流程中涉及的部分反应的化学方程式为:
Al(OH)3 + NaOH === NaAlO2 + 2H2O (NaAlO2可溶于水)。
请回答下列问题。
(1)上述氧化物中能与水反应的是 。
(2)粉煤灰与过量的盐酸反应的主要化学方程式是 (写出其中的一个)。
(3)操作2的名称是 。
(4)固体Ⅱ含有的主要物质的化学式为 。
(5)溶液Ⅱ与过量的CO2反应的化学方程式为:
NaAlO2 + CO2 + 2H2O === Al(OH)3↓ + 。
【答案】(1)SO2 (2)Al2O3 + 6HCl === 2AlCl3 + 3H2O或CuO + 2HCl === CuCl2 + H2O
或Fe2O3 + 6HCl === 2FeCl3 + 3H2O (3)过滤
(4)Fe(OH)3、Cu(OH)2 (5)NaHCO3
【解析】
试题分析:(1)能与水发生反应的氧化物是SO2
(2)酸能与金属氧化物反应,在粉煤灰中的五种氧化物里,其中SiO2和SO2是非金属氧化物,不能与盐酸反应,其它三种都可与盐酸反应,方程式为:Al2O3 + 6HCl === 2AlCl3 + 3H2O或CuO + 2HCl === CuCl2 + H2O或Fe2O3 + 6HCl === 2FeCl3 + 3H2O
(3)操作2是把不溶性固体与溶液分离,是过滤
(4)操作1加入过量的盐酸后,溶液Ⅰ中含有CuCl2和FeCl3,它们会和NaOH反应,方程式分别是:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4、FeCl3+3NaOH==Fe(OH)3↓+3NaCl,即生成了沉淀Cu(OH)2和Fe(OH)3,所以固体Ⅱ含有的主要物质的化学式为:Fe(OH)3、Cu(OH)2
(5)根据质量守恒定律的微观解释:化学反应前后的原子种类、个数不变,可推出为NaHCO3