题目内容
【题目】某纯碱样品中含有少量的氯化钠杂质,为了测定样品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算: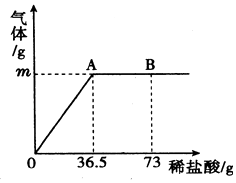
(1)A点产生气体的质量为;
(2)样品中碳酸钠的质量分数(结果精确到0.1%);
(3)B点时,烧杯内溶液中溶质的化学式 .
【答案】
(1)2.2g
(2)
解:设6g试样中Na2CO3质量为x
Na2CO3+2HCl=2NaCl+H2O+ | CO2↑ |
106 | 44 |
x | 2.2g |
106:44=x:2.2g
x=5.3g
试样中Na2CO3的质量分数为: ![]() ×100%≈88.3%
×100%≈88.3%
(3)NaCl、HCl
【解析】解:根据质量守恒定律可得,生成二氧化碳的质量为6g+36.5g﹣40.3g=2.2g
设6g试样中Na2CO3质量为x
Na2CO3+2HCl=2NaCl+H2O+ | CO2↑ |
106 | 44 |
x | 2.2g |
106:44=x:2.2g
x=5.3g
试样中Na2CO3的质量分数为: ![]() ×100%≈88.3%
×100%≈88.3%
由于B点时HCl已经过量,所以B点时烧杯内的溶质为生成的NaCl和过量的HCl
答:(1)A点产生气体的质量为 2.2g;(2)样品中碳酸钠的质量分数约为88.3%;(3)B点时,烧杯内溶液中溶质的化学式 NaCl、HCl.
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.

【题目】下表中知识的归纳正确的是
A用语 | 2O表示两个氧元素 2O2表示两个氧分子 | B安全 | 有机物都易燃,都要远离火源 安全封闭房间烧含碳燃料要防CO中毒 |
C环保 | 生活垃圾集中焚烧用于发电 新制木家具通风放置让甲醛挥发 | D生活 | 儿童需补钙是因为缺乏微量元素钙 糖类、脂肪、蛋白质和水都是营养素 |
A. A B. B C. C D. D