题目内容
如图所示的实验中,反应前氧化铁和碳粉的质量分别为16克和0.6克,反应后得到气体A和14.4克黑色固体B.
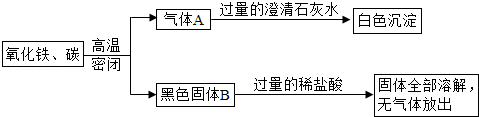
(1)计算白色沉淀的质量;
(2)通过计算推断黑色固体B的化学式.
(1)10g;(2)FeO.
【解析】
试题分析:(1)由题意可知,生成的气体A是二氧化碳,生成二氧化碳的质量=16g+0.6g﹣14.4g=2.2g
设生成白色沉淀的质量为x
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
2.2g x
根据: 解得x=10g
解得x=10g
(2)根据现象判断黑色固体没有铁和碳.
氧化铁中含铁元素的质量=16g× ×100%=11.2g;
×100%=11.2g;
根据反应前后元素种类不变,则B中铁元素的质量为11.2g,则黑色固体B中含氧元素的质量=14.4g﹣11.2g=3.2g
若固体B的化学式为FexOy,由化合物中
原子的个数比= 则x:y=
则x:y=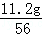 :
: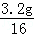 =1:1;
=1:1;
所以固体B的化学式为:FeO.
考点:根据化学反应方程式的计算.

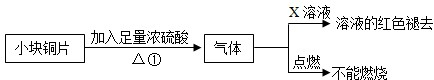
某活动小组的同学在探究金属与酸反应时,发现铜与浓硫酸在加热条件下能够发生反应,并产生大量气体。
【提出问题】产生气体的成分是什么呢?
【分析讨论】经分析讨论,大家认为产生的气体可能是H2SO2SO3O2等气体,经进一步查验后确认没有SO3
O2,于是大家决定进一步探究气体成分。
【提出猜想】
猜想①:产生的气体仅为SO2;
你认为猜想②: ;
猜想③:产生的气体为SO2和H2的混合气。
【查阅资料】1H2能燃烧,不能使红色品红溶液褪色。
2SO2不能燃烧,能使红色的品红溶液褪色,是一种有毒气体,
化学性质与CO2相似。
【设计实验】该小组的同学据此设计并完成了如图所示的实验:
 |
【分析与结论】
(1)图中X为 溶液。
(2)由以上实验可知:猜想 (填①或②或③)正确。
【反思与评价】
(3)实验结束后,有同学认为多余的气体应通入一个装有NaOH溶液的烧杯中,
其原因是 。
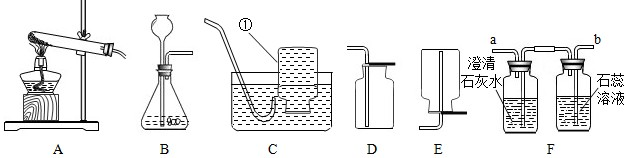
 某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应: