题目内容
镁是活泼的金属,在空气中易被氧化形成金属氧化物.为了探究一块表面被氧化的镁条的组成,某同学在实验室用未知浓度的稀盐酸分别进行了三次实验,实验记录如下表:| 第一次 | 第二次 | 第三次 | |
| 镁条质量/g | 1.5 | 3 | 6 |
| 盐酸质量/g | 150 | 150 | 150 |
| 反应后的混合物质量/g | 151.4 | 152.8 | 155.7 |
(1)原单质镁表面发生氧化反应的化学方程式为:______.
(2)镁条中单质镁的质量分数是多少?
(3)第三次实验后的溶液中,溶质的质量是多少?
【答案】分析:(1)反应物和生成物已经给出,只要配平和注明气体符号和反应条件等.
(2)分析表格可以发现,第一次镁已经和盐酸已经开始反应,并且盐酸有剩余.
(3)分析表格发现,每加入1.5克金属放出氢气的质量是0.1克,所以加入6克金属,放出氢气的质量应该是0.4克,大于0.3克,因此镁条过量,酸完全反应.
解答:解::(1)反应物和生成物已经给出,只要配平和注明气体符号和反应条件即可,故答案为:2Mg+O2=2MgO.
(2)比较第一次和第二次可以发现,盐酸都是150克,当镁条的质量增大时,氢气的质量也随之增加.说明第一次镁已经和盐酸已经开始反应,并且盐酸有剩余,生成H2的质量为1.5克+150克-151.4克=0.1 克,设需要镁的质量是X.
Mg+2HCl=MgCl2+H2↑
24 2
X 0.1克
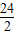 ═
═
得:X=1.2克
∴镁条中单质镁的质量分数为= ×100%=80%.
×100%=80%.
(3)分析表格发现,每加入1.5克金属放出氢气的质量是0.1克,所以加入6克金属,放出氢气的质量应该是0.4克,大于0.3克,因此第三次中镁条过量,酸完全反应.第三次实验中,生成的氢气质量为 6克+150克-155.7克=0.3克,6克镁条中含MgO 的质量=6克×(1-80%)=1.2克,镁的质量=6克×80%=4.8克.设和氧化镁反应生成氯化镁的质量是Y,和镁反应生成氯化镁的质量是Z.
MgO+2HCl=MgCl2+H2O
40 95
1.2克 Y
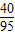 ═
═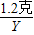
得:Y=2.85克
Mg+2HCl=MgCl2+H2↑
95 2
Z 0.3克
 ═
═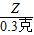
得:Z=14.25克
∴溶质的质量=2.85克+14.25克=17.1克.
答:镁条中单质镁的质量分数是80%;第三次实验后的溶液中,溶质的质量是17.1克.
点评:学会分析表格的方法,注意(3)溶质包含两部分:和氧化镁反应生成氯化镁以及和镁反应生成氯化镁.
(2)分析表格可以发现,第一次镁已经和盐酸已经开始反应,并且盐酸有剩余.
(3)分析表格发现,每加入1.5克金属放出氢气的质量是0.1克,所以加入6克金属,放出氢气的质量应该是0.4克,大于0.3克,因此镁条过量,酸完全反应.
解答:解::(1)反应物和生成物已经给出,只要配平和注明气体符号和反应条件即可,故答案为:2Mg+O2=2MgO.
(2)比较第一次和第二次可以发现,盐酸都是150克,当镁条的质量增大时,氢气的质量也随之增加.说明第一次镁已经和盐酸已经开始反应,并且盐酸有剩余,生成H2的质量为1.5克+150克-151.4克=0.1 克,设需要镁的质量是X.
Mg+2HCl=MgCl2+H2↑
24 2
X 0.1克
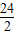 ═
═
得:X=1.2克
∴镁条中单质镁的质量分数为=
 ×100%=80%.
×100%=80%.(3)分析表格发现,每加入1.5克金属放出氢气的质量是0.1克,所以加入6克金属,放出氢气的质量应该是0.4克,大于0.3克,因此第三次中镁条过量,酸完全反应.第三次实验中,生成的氢气质量为 6克+150克-155.7克=0.3克,6克镁条中含MgO 的质量=6克×(1-80%)=1.2克,镁的质量=6克×80%=4.8克.设和氧化镁反应生成氯化镁的质量是Y,和镁反应生成氯化镁的质量是Z.
MgO+2HCl=MgCl2+H2O
40 95
1.2克 Y
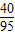 ═
═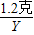
得:Y=2.85克
Mg+2HCl=MgCl2+H2↑
95 2
Z 0.3克
 ═
═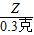
得:Z=14.25克
∴溶质的质量=2.85克+14.25克=17.1克.
答:镁条中单质镁的质量分数是80%;第三次实验后的溶液中,溶质的质量是17.1克.
点评:学会分析表格的方法,注意(3)溶质包含两部分:和氧化镁反应生成氯化镁以及和镁反应生成氯化镁.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
镁是活泼的金属,在空气中易被氧化形成金属氧化物.为了探究一块表面被氧化的镁条的组成,某同学在实验室用未知浓度的稀盐酸分别进行了三次实验,实验记录如下表:
分析上述数据后,回答:(假设:镁条中单质与氧化物的质量比一定;镁条在酸溶液中与氧化物反应后再与单质反应)
(1)原单质镁表面发生氧化反应的化学方程式为: .
(2)镁条中单质镁的质量分数是多少?
(3)第三次实验后的溶液中,溶质的质量是多少?
| 第一次 | 第二次 | 第三次 | |
| 镁条质量/g | 1.5 | 3 | 6 |
| 盐酸质量/g | 150 | 150 | 150 |
| 反应后的混合物质量/g | 151.4 | 152.8 | 155.7 |
(1)原单质镁表面发生氧化反应的化学方程式为:
(2)镁条中单质镁的质量分数是多少?
(3)第三次实验后的溶液中,溶质的质量是多少?
镁是活泼的金属,在空气中易被氧化形成金属氧化物.为了探究一块表面被氧化的镁条的组成,某同学在实验室用未知浓度的稀盐酸分别进行了三次实验,实验记录如下表:
| 第一次 | 第二次 | 第三次 | |
| 镁条质量/g | 1.5 | 3 | 6 |
| 盐酸质量/g | 150 | 150 | 150 |
| 反应后的混合物质量/g | 151.4 | 152.8 | 155.7 |
(1)原单质镁表面发生氧化反应的化学方程式为:______.
(2)镁条中单质镁的质量分数是多少?
(3)第三次实验后的溶液中,溶质的质量是多少?