题目内容
【题目】我市拥有丰富的海洋资源,综合利用这些宝贵的资源有力地促进了我市经济的发展. 
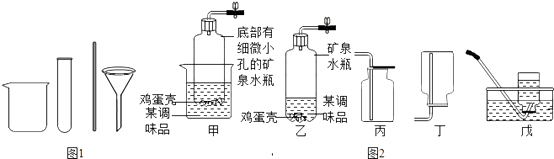
(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质.请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:(如图1)其中操作1的名称是;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、(填仪器名称);在加热蒸发过程中,当蒸发皿中时,停止加热.
(2)上述除去泥沙后的澄清滤液中,还含有Ca2+、Mg2+等阳离子.要想知道该滤液是硬水还是软水,可加入进行检验.
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁.工业上从母液中提取氯化镁的过程如图2:反应1的基本反应类型是;物质X是(填名称).
(4)工业上可用电解饱和NaCl溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式:;
(5)从如图装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为(用接口处字母填写). 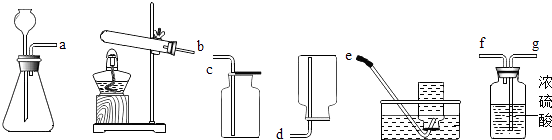
写出一个在实验室中用加热法制取氧气的化学方程式: .
【答案】
(1)溶解;漏斗;出现较多量晶体
(2)肥皂水
(3)复分解反应;盐酸
(4)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(5)a、g、f、d;2KMnO4 ![]() K2MnO4+MnO2↑+O2↑或2KClO3
K2MnO4+MnO2↑+O2↑或2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
【解析】解:(1)去除泥沙的步骤是:①溶解:把粗盐放入烧杯中,加水溶解;②过滤:架好漏斗,使漏斗下端口紧贴烧杯内壁,沿玻璃棒把上述悬浊液慢慢导入漏斗中;该过程中用到的玻璃仪器主要有烧杯、玻璃棒和漏斗等;③蒸发结晶:将上述滤液倒入蒸发皿中,用酒精灯加热蒸发,待蒸发皿中出现较多量晶体时即停止加热;(2)硬水是指含有较多钙镁离子的水,软水是指含有较少钙镁离子的水.区分硬水和软水的方法是:用肥皂水,加入肥皂水,泡沫多的是软水,泡沫少的是硬水;(3)反应Ⅰ氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀,是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;反应Ⅱ将碱转化成了盐,应该加入酸;(4)工业生产通过电解饱和食盐水得到烧碱、氯气、氢气,反应的化学方程式为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(5)在实验室中,常用锌粒与稀硫酸在常温下制取氢气,故选择第一套装置来制取,利用此反应组装一套制取干燥氢气的装置,所选用的装置连接顺序是:利用A装置制取的氢气导出后,进入F装置中,通过浓硫酸干燥后,利用D装置可以收集到干燥的氢气.在实验室中通常用加热高锰酸钾分解为锰酸钾、二氧化锰和氧气;氯酸钾以二氧化锰作催化剂加热分解为氯化钾和氧气两种方法来制取氧气. 所以答案是:(1)溶解;漏斗;出现较多固体;(2)肥皂水;(3)复分解反应;盐酸;(4)2NaCl+2H2O
2NaOH+H2↑+Cl2↑;(5)在实验室中,常用锌粒与稀硫酸在常温下制取氢气,故选择第一套装置来制取,利用此反应组装一套制取干燥氢气的装置,所选用的装置连接顺序是:利用A装置制取的氢气导出后,进入F装置中,通过浓硫酸干燥后,利用D装置可以收集到干燥的氢气.在实验室中通常用加热高锰酸钾分解为锰酸钾、二氧化锰和氧气;氯酸钾以二氧化锰作催化剂加热分解为氯化钾和氧气两种方法来制取氧气. 所以答案是:(1)溶解;漏斗;出现较多固体;(2)肥皂水;(3)复分解反应;盐酸;(4)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(5)a、g、f、d;2KMnO4
2NaOH+Cl2↑+H2↑;(5)a、g、f、d;2KMnO4 ![]() K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3 ![]() 2KCl+3O2↑.
2KCl+3O2↑.
【考点精析】根据题目的已知条件,利用过滤操作的注意事项和硬水与软水的相关知识可以得到问题的答案,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;硬水和软水的鉴别方法:用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水.

【题目】如图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化.下列符合上述要求的一组物质是( )
甲 | 乙 | 丙 | X | Y | Z | |
A | HCl | NaOH | Na2CO3 | Cu | CuO | CuSO4 |
B | HCl | Ba(OH)2 | Na2CO3 | H2O2 | H2O | O2 |
C | H2SO4 | NaOH | K2CO3 | C | CO | CO2 |
D | H2SO4 | Ba(OH)2 | K2CO3 | CaO | Ca(OH)2 | CaCO3 |

A.A
B.B
C.C
D.D
【题目】如表是NaCl、KNO3在不同温度时的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
据此数据,下列有关说法中错误的是( )
A.在40℃时,100g水中最多可溶解KNO363.9g
B.KNO3和NaCl的溶解度曲线在20℃~40℃温度范围内相交
C.在60℃时,KNO3饱和溶液210g加入10g水后,溶质质量分数为50%
D.在20℃时KNO3和NaCl的混合溶液100g,恒温蒸发,先析出的晶体一定是NaCl
【题目】下列三套装置(见如图)都可用于实验室制取CO2 . 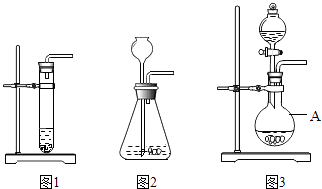
(1)写出实验室制取CO2的化学方程式;
(2)仪器A的名称是;
(3)利用图2装置制取CO2时,长颈漏斗的下端管口必须浸没在溶液中,理由是;
(4)图1和图3装置相比,利用图1装置来制取CO2时,主要不足是(写出一点即可);
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定质量的石灰石样品,将20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入5g | 1.5g |
第二次加入5g | 1.0g |
第三次加入5g | 0.5g |
第四次加入5g | 0.3g |
石灰石样品中碳酸钙的质量分数为;
原稀盐酸中溶质的质量分数为多少?(写出计算过程)