题目内容
【题目】白钨矿的主要成分是CaWO4,含有二氧化硅、氧化铁等杂质,工业生产钨流程如下:
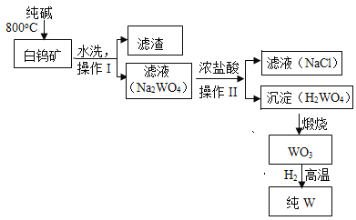
(1)白钨矿反应前需要进行粉碎,其目的是____________________
(2)操作I、II均为____________操作,此操作所用到的玻璃仪器有烧杯、漏斗、________________
(3)写出Na2WO4与浓盐酸发生反应的化学方程式________________________,上述流程中没有涉及到的化学反应基本类型为________________
(4)写出金属钨的一种用途____________________
【答案】增大接触面积,加快反应速率 过滤 玻璃棒 ![]() 化合反应 照明材料
化合反应 照明材料
【解析】
800℃时,CaWO4、SiO2和纯碱反应生成Na2WO4、Na2SiO3,然后水洗得到滤液中成分为Na2WO4、Na2SiO3,滤渣中成分为Fe2O3,根据完全沉淀离子的pH值:SiO32-为8、WO42-为5知,向滤液中加入稀盐酸将溶液的pH调节得到滤渣为H2SiO3,得到母液中含有Na2WO4,然后向母液中加入盐酸得到H2WO4,将钨酸煅烧得到WO3,高温条件下,WO3和H2发生氧化还原反应生成W。
(1)白钨矿反应前需要进行粉碎,其目的是增大接触面积,加快反应速率。
(2)操作I、II是将液体和固体分离,均为过滤操作,此操作所用到的玻璃仪器有烧杯、漏斗、玻璃棒。
(3)Na2WO4与浓盐酸发生反应生成氯化钠和H2WO4,反应的化学方程式为
![]() ,H2WO4煅烧生成WO3属于分解反应,WO3和氢气反应属于置换反应,Na2WO4与浓盐酸反应属于复分解反应,上述流程中没有涉及到的化学反应基本类型为化合反应。
,H2WO4煅烧生成WO3属于分解反应,WO3和氢气反应属于置换反应,Na2WO4与浓盐酸反应属于复分解反应,上述流程中没有涉及到的化学反应基本类型为化合反应。
(4)金属钨的一种用途是作照明材料。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】实验室中有一瓶标签受损的无色液体,如图所示。这瓶无色液体是什么呢? 某化学小组的学生进行了讨论
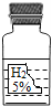
(1)大家讨论后一致认为不可能是蒸馏水,请说出理由是_____。
实验操作 | 实验现象 | 实验结论 |
步骤一:取该液体适量于试管中,向其中加入少量_____粉末。 | 没有气泡产生。 | 该液体不是过氧化氢溶液。 |
步骤二:取该液体适量于试管中,向其中滴加少量氯化钡溶液。 | _____ | 该液体是稀硫酸。 |
(2)如果该液体可以用来制取氧气,写出反应的方程式_____。
(3)甲同学测定该液体能使紫色的石蕊试液变红,则该液体可能是_____(写一种符合条件的化学式)。
(4)吸附剂中主要物质为SiO2和CaCl2, CaCl2中钙、氯元素的质量比为_____。