题目内容
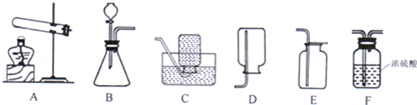
我们学过有六种途径可以制得氧气,如图所示: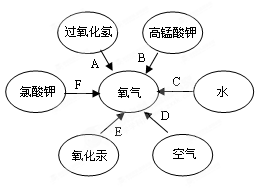
(1)写出途径B制得氧气的反应化学方程式: 。
(2)六种制得氧气的途径中,属于物理变化的途径是 (填字母代号);在发生化学变化的途径中,它们的基本反应类型是 。
(3)为了使A、F两种途径更快地制取氧气,还需要加入 。
(4)根据“绿色化学”理念,通常 (填字母代号) 途径是实验室制氧气的最佳方法。
(6分)
(1)2KMnO4 K2MnO4+MnO2+O2↑(2分)(2)(2分)D 分解反应
K2MnO4+MnO2+O2↑(2分)(2)(2分)D 分解反应
(3)(1分)二氧化锰作催化剂 (4)(1分)A
解析试题分析:(1)用高锰酸钾制取氧气的反应化学方程式为:2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(2)D项用空气制氧气,是将空气中原有的氧气分离出来。发生的物理变化。
(3)为了使A、F两种途径更快地制取氧气,可加入起催化作用的催化剂二氧化锰。两个反应都是由一种物质生成两种物质的化学反应,所以都属于分解反应。
(4)A是使用过氧化氢在常温下分解生成水和氧气不产生污染。符合绿色化学的要求。
考点:氧气的制取

 名校课堂系列答案
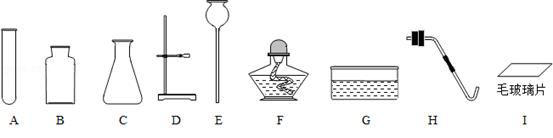
名校课堂系列答案如图是实验室常用的气体制备、收集的多种功能装置。




A B C D E F
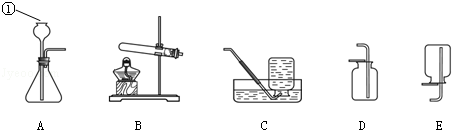
(1)若实验室用A装置加热氯酸钾和二氧化锰混合物制取氧气,其化学方程式为 。
(2)若B装置X中盛放稀盐酸、Y中盛放石灰石,B与C组成发生、收集CO2气体的系列装置,检验CO2收满的方法是 ,检验制得气体是否为二氧化碳的化学方程式为 。
(3)若实验室用锌粒和稀硫酸制取氢气,可选择的发生装置为 ,反应的化学方程式为 。若用排水法收集并测定氢气的体积,氢气从E装置导管口 (填“g”或“h”) 进。选用仪器F测量排出水的体积,仪器F的名称是 。
(4)对锌与稀硫酸反应快慢的影响因素进行探究。反应过程中,利用前10min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下:
| 实验编号 | 试剂 | 前 10 min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和溶质质量分数的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
Ⅰ. 比较实验a和实验b,可以得到的结论是 。
Ⅱ.要比较不同溶质质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
Ⅲ. 控制其他条件相同,还需考虑控制的条件是 (例举一种条件即可)。

 2MnSO4+2X+O2↑
2MnSO4+2X+O2↑
 NH3↑+HCl↑
NH3↑+HCl↑