题目内容
将铜、锌两种金属的混合物20g,放入100g稀硫酸中恰好完全反应,共放出0.2g氢气.
求:(1)原混合物中锌的质量百分含量.
(2)反应后所得溶液的质量百分比浓度.
解:设混合物中含锌的质量为x,生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
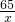 ═
═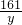 ═
═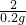
解得x=6.5g,y=16.1g
混合物中锌的质量百分含量= ×100%=32.5%
×100%=32.5%
反应后硫酸锌溶液的质量=6.5g+100g-0.2g=106.3g
反应后硫酸锌溶液的质量百分比浓度=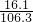 ×100%=15.1%
×100%=15.1%
答:(1)原混合物中锌的质量百分含量为32.5%;(2)反应后所得溶液的质量百分比浓度为15.1%.
分析:(1)不与硫酸反应而锌与硫酸反应生成硫酸锌和氢气,因此利用反应放出氢气的质量,根据反应的化学方程式可计算出混合物中含金属锌的质量,从而求得原混合物中锌的质量百分含量即质量分数;
(2)恰好完全反应后所得溶液为反应生成的硫酸锌的溶液,因此求反应后所得溶液的质量百分比浓度(即溶质的质量分数)应解决生成硫酸锌的质量及反应后所得溶液的质量;根据反应的化学方程式由生成氢气质量可求得生成硫酸锌的质量,利用质量守恒定律可求得反应后所得溶液的质量,从而解决反应后所得溶液的质量百分比浓度.
点评:根据质量守恒定律,恰好完全反应后所得硫酸锌溶液的质量=金属锌的质量+所加稀硫酸的质量-放出氢气的质量,这样可使溶液质量的计算简捷.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
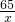 ═
═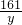 ═
═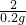
解得x=6.5g,y=16.1g
混合物中锌的质量百分含量=
 ×100%=32.5%
×100%=32.5% 反应后硫酸锌溶液的质量=6.5g+100g-0.2g=106.3g
反应后硫酸锌溶液的质量百分比浓度=
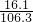 ×100%=15.1%
×100%=15.1% 答:(1)原混合物中锌的质量百分含量为32.5%;(2)反应后所得溶液的质量百分比浓度为15.1%.
分析:(1)不与硫酸反应而锌与硫酸反应生成硫酸锌和氢气,因此利用反应放出氢气的质量,根据反应的化学方程式可计算出混合物中含金属锌的质量,从而求得原混合物中锌的质量百分含量即质量分数;
(2)恰好完全反应后所得溶液为反应生成的硫酸锌的溶液,因此求反应后所得溶液的质量百分比浓度(即溶质的质量分数)应解决生成硫酸锌的质量及反应后所得溶液的质量;根据反应的化学方程式由生成氢气质量可求得生成硫酸锌的质量,利用质量守恒定律可求得反应后所得溶液的质量,从而解决反应后所得溶液的质量百分比浓度.
点评:根据质量守恒定律,恰好完全反应后所得硫酸锌溶液的质量=金属锌的质量+所加稀硫酸的质量-放出氢气的质量,这样可使溶液质量的计算简捷.

练习册系列答案
相关题目