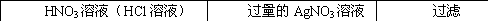题目内容
(10滨州24)、(5分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 ;
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;
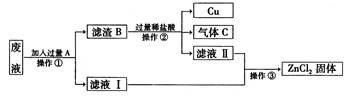
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。

上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ;由无水MgCl2制取Mg的化学方程式为 。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
(1)从海水中获取淡水。常用的操作方法是 ;
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。

上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ;由无水MgCl2制取Mg的化学方程式为 。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
(5分)(1)蒸馏法
(2)蒸发结晶
(3)Mg(OH)2, MgCI2 Mg+Cl2↑后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低) (每空1分)
Mg+Cl2↑后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低) (每空1分)
(2)蒸发结晶
(3)Mg(OH)2, MgCI2
 Mg+Cl2↑后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低) (每空1分)
Mg+Cl2↑后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低) (每空1分)分析:蒸馏可以淡化海水,蒸发可以得到粗盐;根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.
解答:解:(1)从海水中获取淡水.常用的操作方法是蒸馏;故填:蒸馏.
(2)从海水中获得氯化钠.将海水进行蒸发可得到粗盐;故填:蒸发.
(3)沉淀B与试剂C发生的是中和反应,则沉淀B是氢氧化镁.故填:Mg(OH)2.
由无水MgCl2制取Mg的化学方程式为:MgCl2 Mg+Cl2↑.
Mg+Cl2↑.
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液相比较,海水中氯化镁的浓度低.故填:海水中氯化镁的浓度低.
解答:解:(1)从海水中获取淡水.常用的操作方法是蒸馏;故填:蒸馏.
(2)从海水中获得氯化钠.将海水进行蒸发可得到粗盐;故填:蒸发.
(3)沉淀B与试剂C发生的是中和反应,则沉淀B是氢氧化镁.故填:Mg(OH)2.
由无水MgCl2制取Mg的化学方程式为:MgCl2
 Mg+Cl2↑.
Mg+Cl2↑.海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液相比较,海水中氯化镁的浓度低.故填:海水中氯化镁的浓度低.

练习册系列答案
相关题目