题目内容
【题目】铁、铜和银是日常生活中经常接触到的三种金属。
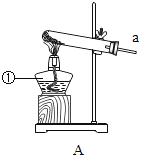
(1)若要证明铁、铜和银的活动性顺序,需要进行的实验有____(填序号)。
A 将铁片放入盐酸中 B 将铜片放入盐酸中
C 将铁片放入硝酸银溶液中 D 将铜片放入硝酸银溶液中
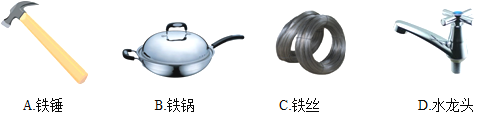
(2)下列铁制品的用途中,利用金属导热性的是____(填字母)。
(3)汽车表面喷漆不仅美观,而且可有效防止铁与____和____接触而生锈。
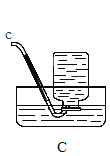
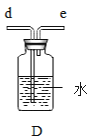
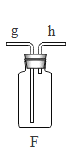
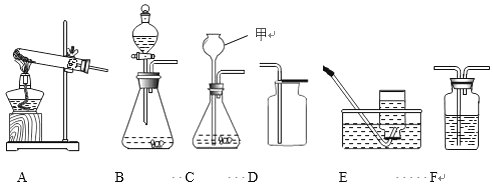
(4)氧化铁是一种红褐色的固体粉末,请据图回答问题(X、E为不同物质)。
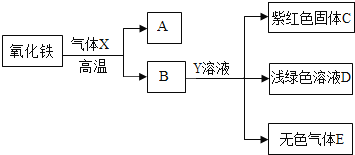
①写出气体X与氧化铁反应的化学方程式_____。
②Y溶液中含有的物质为____(写出一种组合即可).
③写出生成紫红色固体C的化学方程式_____。
【答案】ABD B 氧气 水 Fe2O3+3CO![]() 2Fe+3CO2 稀硫酸和硫酸铜 Fe+CuSO4=FeSO4+Cu
2Fe+3CO2 稀硫酸和硫酸铜 Fe+CuSO4=FeSO4+Cu
【解析】
(1)要证明铁、铜和银的活动性顺序,需要进行的实验有
A、将铁片放入盐酸中,能产生氢气,说明: Fe >H;故选项正确;
B、将铜片放入盐酸中,不能产生氢气,说明H>Cu;故选项正确;
C、将铁片放入硝酸银溶液中,属于多余操作;故选项错误;
D、将铜片放入硝酸银溶液中,能发生置换反应,说明:Cu>Ag;故选项正确;
故选:ABD。
(2)
A、铁锤,利用其硬度大的性质;故选项错误;
B、铁锅,利用其导热性好的性质;故选项正确;
C、铁丝,利用其延展性;故选项错误;
D、水龙头,利用其抗腐蚀性;故选项错误;
故选:B。
(3)汽车表面喷漆不仅美观,而且可有效防止铁与氧气和水接触而生锈。
(4)氧化铁是一种红褐色的固体粉末,
①写出气体X是一氧化碳,一氧化碳还原氧化铁:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
②A是二氧化碳,B是金属铁,铁与Y溶液反应产生紫红色固体C,则C是铜;浅绿色溶液中含有亚铁离子,无色气体是氢气;所以Fe+CuSO4=FeSO4+Cu,铁与稀硫酸反应原理:Fe+H2SO4=FeSO4+H2↑;Y溶液中含有的物质可以为:稀硫酸和硫酸铜;
③写出铁与硫酸铜溶液发生置换反应生成紫红色固体C的化学方程式:Fe+CuSO4=FeSO4+Cu。