题目内容
【题目】某化学小组同学为了测定实验室一瓶稀盐酸中溶质的质量分数。他们用铜锌合金和此稀盐酸完成了如图的实验。
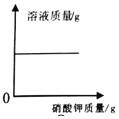
(1)恰好完全反应时生成氢气的质量是_____g;
(2)该瓶稀盐酸中溶质的质量分数_____。

【答案】0.2该瓶盐酸溶液溶质质量分数为7.3%
【解析】
依据铜锌合金中锌能够和盐酸反应时只有锌能反应而铜不反应,利用质量守恒定律可以求出氢气的质量,利用氢气的质量,根据反应的化学方程式求出参加反应的氯化氢质量,据此分析解答。
(1)依据反应中锌和盐酸反应可以生成氢气,根据质量守恒定律,生成氢气的质量为10g+100g﹣109.8g=0.2g;(2)设参加反应的氯化氢质量为x,
Zn+2HCl═ZnCl2+H2↑
73 2
x 0.2g
![]()
x=7.3g,
该瓶盐酸溶液溶质质量分数为![]() ×100%=7.3%;
×100%=7.3%;
答:(1)恰好完全反应时生成氢气的质量是0.2g;(2)该瓶盐酸溶液溶质质量分数为7.3%。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目