题目内容
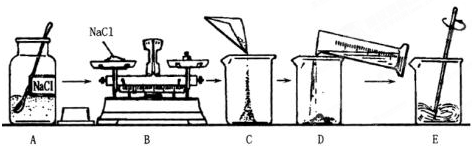
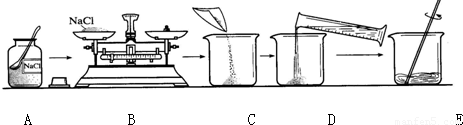
如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:

(1)用图的序号表示配制溶液的正确操作顺序
(2)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图⑥,则需要量取水的体积为(水的密度是1g/mL)
(3)若量取所需水的体积时仰视读数,则所配溶液的溶质质量分数
“不变”).

(1)用图的序号表示配制溶液的正确操作顺序
②⑤①④③
②⑤①④③
.(2)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图⑥,则需要量取水的体积为(水的密度是1g/mL)
163.8
163.8
ml.(3)若量取所需水的体积时仰视读数,则所配溶液的溶质质量分数
偏低
偏低
(填“偏高”、“偏低”或“不变”).
分析:(1)根据配制溶液的步骤:计算、称量、溶解分析解答;
(2)根据图可知称量氯化钠的质量为18.2g,从而求出水的体积进行解答;
(3)根据若量取所需水的体积时仰视读数,会使得水的实际体积增大进行解答.
(2)根据图可知称量氯化钠的质量为18.2g,从而求出水的体积进行解答;
(3)根据若量取所需水的体积时仰视读数,会使得水的实际体积增大进行解答.
解答:解:(1)配制固体溶质的溶液的步骤是:先计算再称量再量取最后溶解,故正确顺序是:②⑤①④③;
(2)根据图可知称量氯化钠的质量为18.2g,所以溶液的质量=
=182.0g,所以水的质量=182.0g-18.2g=163.8g,水的密度是1g/mL,所以水的体积163.8mL;故填:163.8;
(3)若量取所需水的体积时仰视读数,会使得水的实际体积增大,所以所配溶液的溶质质量分数会偏低.故填:偏低.
(2)根据图可知称量氯化钠的质量为18.2g,所以溶液的质量=
| 18.2g |
| 10% |
(3)若量取所需水的体积时仰视读数,会使得水的实际体积增大,所以所配溶液的溶质质量分数会偏低.故填:偏低.
点评:熟练掌握配制溶液的步骤,仪器,溶质的质量分数计算是解答此题的基础和关键.

练习册系列答案
相关题目