题目内容
某有机物4.4g在氧气中充分燃烧,生成13.2g二氧化碳和7.2g水.由此可确定该物质是由 元素组成的,如果该物质的相对分子质量是44,该物质的化学式为 .
【答案】
碳、氢;C3H8.
【解析】
试题分析:该物质燃烧生成二氧化碳和水,根据质量守恒定律可确定该物质中一定含有碳和氢元素;
13.2g二氧化碳中碳元素的质量为:13.2g×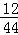 =3.6g,
=3.6g,
7.2g水中氢元素的质量为:7.2g× =0.8g,
=0.8g,
生成的二氧化碳中碳元素和水中氢元素的质量共为3.6g+0.8g=4.4g,所以该有机物中不含有氧元素;
该有机物中碳氢元素的质量比是3.6g:0.8g=9:2,设该有机物的化学式为CxHy,所以12x:y=9:2,x:y=3:8,
又该物质的相对分子质量是44,因此该物质的化学式为C3H8.
考点:质量守恒定律及其应用.
点评:本题主要考查学生运用质量守恒定律进行推断的能力,难点在于结合化学式的计算确定有机物中是否含有氧元素.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
化学上常用燃烧法测定有机物的组成.现取4.6g某有机物在足量氧气中充分燃烧,生成8.8g CO2和5.4g H2O,则该有机物中( )
| A、只含有碳、氢两种元素 | B、一定含有碳、氢、氧三种元素 | C、碳、氢元素的原子个数比为1:2 | D、碳、氢、氧元素的原子个数比为2:6:1 |
某有机物的相对分子质量为46,4.6g该物质在氧气中充分燃烧生成8.8g二氧化碳和5.4g水,据此判断,该有机物( )
| A、只由碳、氢两种元素组成 | B、一定含有碳、氢、氧三种元素 | C、化学式为CH2O2 | D、分子中C、Η、O原子个数比为2:6:1 |
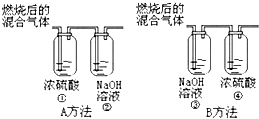 某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).
某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).