题目内容
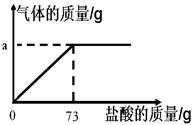
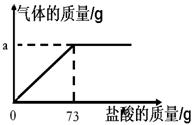
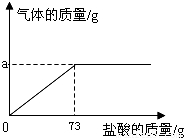
(10佛山28)(7分)为了分析生铁中铁的含量,某学习小组进行了实验研究,即取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见右下图)。说明:生铁中杂质不溶于水,不与盐酸、硫酸铜溶液反应。
(1)铁完全反应用去盐酸的质量为 g。
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(3)某同学列出了如下计算式:
生铁与盐酸刚好反应完全时所得溶液质量= (73+6-a)g
小明对该计算式提出了质疑,请指出其中的错误
(4)小华另设计了一个实验方案,即用6g生铁粉与20%的硫酸铜溶液反应来分析生铁中铁的含量。请你画出加入硫酸铜溶液质量与固体质量变化关系的曲线(见答题卡)。
(1)73(1分)
(2)(共3分,设未知数和作答共0.5分,建立关系式1分,x结果0.5分,质量分数计算1分)
解:设与盐酸反应的铁的的质量为x。 0.5分
Fe +2HCl = FeCl2 + H2↑
56 73
x (73×10%)g
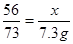
x = 5.6g 0.5分
生铁中铁的质量分数为=(5.6g÷6g)×100% = 93.3% 1分
答:生铁中铁的质量分数为93.3%。
(3)溶液质量不包括氢气质量和剩余杂质的质量,所以还要减去杂质的质量(1分)
(4)(抓住起点、折点及曲线走势给分,不需要标注这些点,共2分)
解析:略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目