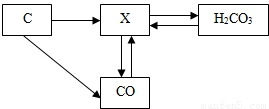
题目内容
(2011?海门市二模)金属材料、合成材料、无机非金属材料是人类生活和生产常用的材料.(1)铝在地壳中含量排第位.钨有“光明使者”的美誉.钨用作灯丝,主要是利用它的.
(2)铀-235是重要的核原料之一.铀原子中共有92个质子,则U2+中有个电子.将四氯化铀与钾在白金坩埚中混合加热(发生置换反应),可获得金属铀颗粒,写出反应方程式:.
(3)由乳酸(C3H6O3)聚合而成的纤维是(填“无机非金属材料”或“合成材料”),适用于做手术缝合线.
(4)世博金条已成为收藏热点.“真金不怕火炼”,是指金的化学性质.黄金和黄铜(Cu-Zn合金)外观相似,可区分它们的化学试剂是.
(5)太阳能光伏发电在世博会上大规模的应用.太阳能光伏发电最关键的材料是高纯硅,生产高纯硅的流程示意图如下:
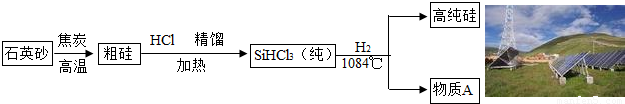
①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是;
②为了达到绿色化学的目的,纯净物A需要循环使用,A的化学式是.
③流程中用焦炭与石英砂反应制取粗硅的反应中,是利用焦炭的性.
【答案】分析:(1)地壳中元素含量由高到低依次是氧、硅、铝、铁;钨的熔点高.
(2)在原子中质子数等于核外电子数;根据质量守恒定律:反应前后元素的种类和原子个数不变,书写化学方程式的要求:写配注等.
(3)乳酸(C3H6O3)是有机物,其聚合而成的纤维属于合成材料,而非无机非金属材料.
(4)金的化学性质不活泼,区别黄金和黄铜(Cu-Zn合金)可利用它的金属活动性.
(5)①根据氢气与氧气反应的情况和Si与氧气反应的情况考虑;
②对照流程图和物质A,进行分析即可.③化学方程式为:SiO2+2C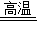 Si+2CO.
Si+2CO.
解答:解:
(1)地壳中元素含量由高到低依次是氧、硅、铝、铁;钨的熔点高;故答案为:三、熔点高
(2)在原子中质子数等于核外电子数,U2+中失去了两个电子;根据质量守恒定律:反应前后元素的种类和原子个数不变,可书写化学方程式;故答案为:90、UCl4+K═U+4KCl
(3)乳酸(C3H6O3)是有机物,其聚合而成的纤维属于有机合成材料,而非无机非金属材料;故答案为:合成材料
(4)真金不怕火炼是说明黄金在火烧的情况下不会发生反应,黄铜中含有锌与酸会生成氢气,而金不能与酸反应;故答案为:不活泼、稀盐酸或硫酸铜溶液等
(5)①在H2还原SiHCl3过程中若混入O2,还原出的Si会被再次氧化,得不到纯净的Si,氢气与氧气会发生反应并放出大量热量,会引起爆炸.故整个制备过程必须达到无水无氧;故答案为:硅易被氧化,易爆炸
②因为H2还原SiHCl3得到高纯硅和HCl,故可判断物质A为HCl,在生产过程中,从粗硅→SiHCl3,要用到HCl,使物质A得到循环利用;故答案为:HCl;③化学方程式为:SiO2+2C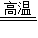 Si+2CO,所以碳做还原剂,具有还原性;故答案为:还原
Si+2CO,所以碳做还原剂,具有还原性;故答案为:还原
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)在原子中质子数等于核外电子数;根据质量守恒定律:反应前后元素的种类和原子个数不变,书写化学方程式的要求:写配注等.
(3)乳酸(C3H6O3)是有机物,其聚合而成的纤维属于合成材料,而非无机非金属材料.
(4)金的化学性质不活泼,区别黄金和黄铜(Cu-Zn合金)可利用它的金属活动性.
(5)①根据氢气与氧气反应的情况和Si与氧气反应的情况考虑;
②对照流程图和物质A,进行分析即可.③化学方程式为:SiO2+2C
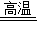 Si+2CO.
Si+2CO.解答:解:
(1)地壳中元素含量由高到低依次是氧、硅、铝、铁;钨的熔点高;故答案为:三、熔点高
(2)在原子中质子数等于核外电子数,U2+中失去了两个电子;根据质量守恒定律:反应前后元素的种类和原子个数不变,可书写化学方程式;故答案为:90、UCl4+K═U+4KCl
(3)乳酸(C3H6O3)是有机物,其聚合而成的纤维属于有机合成材料,而非无机非金属材料;故答案为:合成材料
(4)真金不怕火炼是说明黄金在火烧的情况下不会发生反应,黄铜中含有锌与酸会生成氢气,而金不能与酸反应;故答案为:不活泼、稀盐酸或硫酸铜溶液等
(5)①在H2还原SiHCl3过程中若混入O2,还原出的Si会被再次氧化,得不到纯净的Si,氢气与氧气会发生反应并放出大量热量,会引起爆炸.故整个制备过程必须达到无水无氧;故答案为:硅易被氧化,易爆炸
②因为H2还原SiHCl3得到高纯硅和HCl,故可判断物质A为HCl,在生产过程中,从粗硅→SiHCl3,要用到HCl,使物质A得到循环利用;故答案为:HCl;③化学方程式为:SiO2+2C
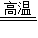 Si+2CO,所以碳做还原剂,具有还原性;故答案为:还原
Si+2CO,所以碳做还原剂,具有还原性;故答案为:还原点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
(2011?海门市二模)下表列出了除去物质中所含少量杂质的方法其中错误的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO | CO2 | 通过足量氢氧化钠溶液,干燥 |
| B | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| C | N2 | O2 | 加入足量C加热至反应完全 |
| D | NaOH溶液 | Na2CO3 | 加适量Ca(OH)2溶液、过滤 |