题目内容
 翰林汇35看图回答下列问题:
翰林汇35看图回答下列问题:
(1)选A、B、C、D依次组装进行实验,片刻后D装置中硫酸铜粉末由白色变为蓝色。判断:①A中产生的气体是__________。C中的氧化铜由_________色,反应前后(用符号填充)______________元素的化合价发生了变化。
②B中用于干燥气体的液体是_________________(填物质名称)。
(2)仍选用图中装置按以下要求的顺序组装实验,在空格内填上所选的装置编
号(本题2分)。
| 实验 要求 | 制CO | 证明CO | CO | CO还原性 | 除去混和气体 |
| 装置 编号 |
①写出实验室制CO2的化学方程式 。
②对CO2与H2O反应后的溶液加热,可观察到石蕊试液____________。
③除去混合气体中的CO2,应通入(填物质的化学式)___________溶液。
(1)①氢气(或H2)、黑色逐渐变成红、Cu,H ②浓硫酸。
(2)AEFCB (3) ①CaCO3+2HCl=CaCl2+CO2↑+H2O
②红色逐渐褪去(或红色逐渐变为紫色)。
③Ca(OH)2

练习册系列答案
相关题目
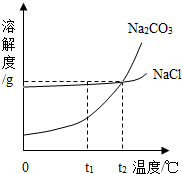 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:(1)①t1℃时,NaCl的溶解度
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
③“夏天晒盐”是利用
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
 15、如图所示是X,Y,Z三种固体物质的溶解度曲线,看图回答下列问题:
15、如图所示是X,Y,Z三种固体物质的溶解度曲线,看图回答下列问题:
