题目内容
元素周期表是学习化学的重要工具.下表是元素周期表的一部分,请回答下列问题:
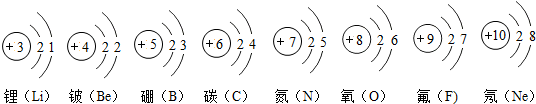
(1)元素周期表中不同种元素最本质的区别是
A.相对原子质量不同 B.质子数不同 C.中子数不同
(2)镁元素的原子结构示意图为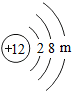 ,则m=
,则m=
(3)元素周期表中每一个横行叫做一个周期.根据下图第二周期各元素的原子结构示意图如右上图,分析同一周期元素之间的排列有一定的规律,如:
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素的原子序数依次递增
C.从左到右,各元素原子的最外层电子数相同
(4)小明在查阅资料时发现镁条能在6号与8号元素组成的化合物(分子中原子个数比为1:2)中燃烧,镁条燃烧时,发出白光,放热,产生一种白色固体和一种黑色固体,该反应的化学方程式是

| 1H | 2He | ||||||
| 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |
B
B
(填字母).A.相对原子质量不同 B.质子数不同 C.中子数不同
(2)镁元素的原子结构示意图为
 ,则m=
,则m=2
2
,该原子在化学反应中易失去
失去
(填“得到”或“失去”)电子,说明元素的化学性质与原子的最外层电子数
最外层电子数
关系密切.(3)元素周期表中每一个横行叫做一个周期.根据下图第二周期各元素的原子结构示意图如右上图,分析同一周期元素之间的排列有一定的规律,如:
AB
AB
(填字母).A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素的原子序数依次递增
C.从左到右,各元素原子的最外层电子数相同
(4)小明在查阅资料时发现镁条能在6号与8号元素组成的化合物(分子中原子个数比为1:2)中燃烧,镁条燃烧时,发出白光,放热,产生一种白色固体和一种黑色固体,该反应的化学方程式是
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
分析:(1)掌握元素的概念:具有相同核电荷数(核内质子数)的一类原子的总称;
(2)由元素周期表中,原子序数为12的镁元素的原子结构示意图可知,其最外层电子数,推测其得失电子情况.
(3)总结归纳是学习化学的一种重要方法:元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律;
(4)镁是一种化学性质比较活泼的气体,可以在二氧化碳中燃烧,根据反应的现象和质量守恒定律,可判断生成的物质为氧化镁和碳.
(2)由元素周期表中,原子序数为12的镁元素的原子结构示意图可知,其最外层电子数,推测其得失电子情况.
(3)总结归纳是学习化学的一种重要方法:元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律;
(4)镁是一种化学性质比较活泼的气体,可以在二氧化碳中燃烧,根据反应的现象和质量守恒定律,可判断生成的物质为氧化镁和碳.
解答:解:(1)根据元素的概念,可知表中不同种元素最本质的区别是质子数不同,故选B;
(2)根据在原子中,质子数等于核外电子数可得m=2,最外层电子数少于4,该原子在化学反应中易失去电子,说明元素的化学性质与原子的最外层电子数关系密切;
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律:从左到右,各元素原子的电子层数相同;从左到右,各元素原子的原子序数依次增加;
(4)6号与8号元素分别是碳和氧,两者组成的化合物是二氧化碳,根据信息可知,镁在二氧化碳中燃烧生成了氧化镁和碳;
故答案为:
(1)B;
(2)2;失去;最外层电子数;
(3)A,B;
(4)2Mg+CO2
2MgO+C.
(2)根据在原子中,质子数等于核外电子数可得m=2,最外层电子数少于4,该原子在化学反应中易失去电子,说明元素的化学性质与原子的最外层电子数关系密切;
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律:从左到右,各元素原子的电子层数相同;从左到右,各元素原子的原子序数依次增加;
(4)6号与8号元素分别是碳和氧,两者组成的化合物是二氧化碳,根据信息可知,镁在二氧化碳中燃烧生成了氧化镁和碳;
故答案为:
(1)B;
(2)2;失去;最外层电子数;
(3)A,B;
(4)2Mg+CO2
| ||
点评:了解元素周期表的特点及其应用;核外电子在化学反应中的作用;了解原子结构示意图与离子结构示意图的特点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ,第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为
,第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为 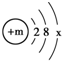 ,则x=
,则x=
 元素周期表是学习化学的重要工具,图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )
元素周期表是学习化学的重要工具,图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )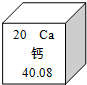 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中获取的信息错误的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中获取的信息错误的是( )