题目内容
(2007?兰州)现代生活中,人们越来越注重微量元素的摄取.碘元素对人体健康有至关重要的作
用.下表是某地市场上销售的一种“加碘食盐”包装袋上的部分说明.
请回答下列问题:
(1)由食用方法和贮藏指南可推测碘酸钾(KIO3)的化学性质之一是
(2)碘酸钾(KIO3)中,钾元素、碘元素、氧元素的质量比是
(3)碘酸钾(KIO3)中,碘元素的质量分数是多少(计算结果精确到0.01,下同)?
(4)计算lkg这样的食盐中应加入多少克碘酸钾(用最高含碘量计算)?
用.下表是某地市场上销售的一种“加碘食盐”包装袋上的部分说明.
| 配料 | 氯化钠、碘酸钾(KIO3) |
| 含碘量 | (20mg~30mg)/kg食盐 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避光、避热、密封、防潮 |
(1)由食用方法和贮藏指南可推测碘酸钾(KIO3)的化学性质之一是
不稳定,易分解
不稳定,易分解
;(2)碘酸钾(KIO3)中,钾元素、碘元素、氧元素的质量比是
39:127:48
39:127:48
;(3)碘酸钾(KIO3)中,碘元素的质量分数是多少(计算结果精确到0.01,下同)?
(4)计算lkg这样的食盐中应加入多少克碘酸钾(用最高含碘量计算)?
分析:(1)根据加碘食盐的食用方法是勿长时间炖炒以及贮藏指南是避光、避热、密封、防潮可知碘酸钾(KIO3)的化学性质不稳定,易分解进行解答;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
(3)根据碘酸钾(KIO3)中,碘元素的质量分数=
×100%进行解答;
(4)根据含碘元素的质量求出lkg这样的食盐中应加入碘酸钾的质量即可.
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
(3)根据碘酸钾(KIO3)中,碘元素的质量分数=
| 碘的相对原子质量×碘原子的个数 |
| 碘酸钾的相对分子质量 |
(4)根据含碘元素的质量求出lkg这样的食盐中应加入碘酸钾的质量即可.
解答:解:(1)加碘食盐的食用方法是勿长时间炖炒以及贮藏指南是避光、避热、密封、防潮可知碘酸钾(KIO3)的化学性质不稳定,易分解;故填:不稳定,易分解;
(2)由化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得碘酸钾(KIO3)中钾元素、碘元素、氧元素的质量比=39:127:48;故填:39:127:48;
(3)碘酸钾(KIO3)中,碘元素的质量分数=
×100%=59.35%;故填:59.35%;
(4)lkg这样的食盐中碘酸钾的质量=
=50mg=0.05g.故填:0.05g.
(2)由化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得碘酸钾(KIO3)中钾元素、碘元素、氧元素的质量比=39:127:48;故填:39:127:48;
(3)碘酸钾(KIO3)中,碘元素的质量分数=
| 127 |
| 39+127+16×3 |
(4)lkg这样的食盐中碘酸钾的质量=
| 30mg |
| 59.35% |
点评:本题考查学生根据物质化学式分析元素质量比,及对化合物中元素的质量分数计算方法的掌握与与在解题中应用能力.

练习册系列答案
相关题目
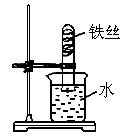
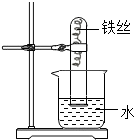 (2007?兰州)小明把一根用砂纸打磨过的铁丝弯成螺旋状放入试管中,如图实验,放置1-2周时间后,装置中能出现的现象是:
(2007?兰州)小明把一根用砂纸打磨过的铁丝弯成螺旋状放入试管中,如图实验,放置1-2周时间后,装置中能出现的现象是: