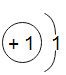题目内容
【题目】A、B、C、D、E是我们学过的五种常见物质,它们之间的转化关系如图所示。
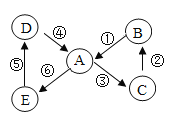
已知A与B可发生反应,C能使带火星的木条复燃,D是石灰石的主要成分,E与D含相同的金属元素。试推断:
(1)D的化学式是______________________;
(2)反应②的化学方程式可能是:______________________;
(3)反应③的基本类型是______________________反应;
(4)反应⑥是______________________(填 “吸热”或“放热”)反应。
【答案】CaCO3 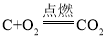 或
或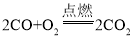 分解 放热
分解 放热
【解析】
由题意已知A与B可发生反应,C能使带火星的木条复燃,则C是氧气,D是石灰石的主要成分,D是碳酸钙,E与D含相同的金属元素钙元素,根据图中各物质的转化关系,可进一步推测E为氢氧化钙,反应⑤为氢氧化钙与二氧化碳反应生成碳酸钙和水,A通过反应③生成氧气,A可以是水、双氧水、高锰酸钾、氯酸钾等物质,碳酸钙可以转化成A,则推测A是水,则反应④为碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应⑥是水和生石灰氧化钙反应生成氢氧化钙,反应③是电解水生成氢气和氧气,B与水能够反应,B是氧气与某物质反应的产物,则推测B为二氧化碳,反应②为含碳元素的物质与氧气反应生成二氧化碳,例如单质碳的燃烧、一氧化碳的燃烧等,反应①为二氧化碳与氢氧化钙反应生成碳酸钙和水,经过验证,以上的物质推断合理。
(1)由分析可知,D是碳酸钙,化学式是![]() ;
;
(2)反应②为含碳元素的物质与氧气反应生成二氧化碳,例如单质碳的燃烧、一氧化碳的燃烧等,反应的化学方程式可能是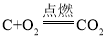 或
或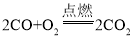 ;
;
(3)反应③是电解水生成氢气和氧气,其基本类型是分解反应;
(4)反应⑥是是水和生石灰氧化钙反应生成氢氧化钙,该反应是放热反应。

 名校通行证有效作业系列答案
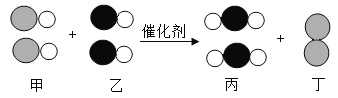
名校通行证有效作业系列答案【题目】某化学研究性学习小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白
(提出问题)Al2O3能不能作过氧化氢分解的催化剂呢?
(作出猜想)Al2O3能作过氧化氢分解的催化剂。
(实验验证)填写表中实验一的步骤和实验二的结论
实验步骤 | 实验现象 | 实验结论 | |
实验一 | _________ | 有少量气泡放出,木条不复燃。 | 常温下过氧化氢溶液分解速率很慢 |
实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中。 | ________ | 加入Al2O3后过氧化氢溶液分解速率很快。 |
(得出结论)Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂;写出该反应的化学方程式____________;该反应属于________反应(填基本反应类型)。
(反思提高)经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验三:
实验三:
(实验目的)探究_____________。
(实验步骤)
①确称取Al2O3的质量(少量);
②按实验二的步骤完成实验;
③待反应结束,将试管中的物质进行过滤,洗涤,烘干,称量;
④对比反应前后Al2O3的质量。
(交流讨论)如果Al2O3在反应前后质量___________,则说明Al2O3是过氧化氢分解的催化剂。
(提出新问题)小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验四;
(实验四目的)探究____________。
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
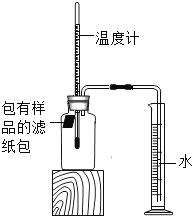
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。