题目内容
(1)现有一包白色固体混合物,可能由BaCl2、KNO3、CuSO4、FeCl3、Na2CO3、Na2SO4、NaCl等中的几种混合而成,为证明其组成,做如下实验:步骤一:取一定量该固体混合物加入足量的水,充分搅拌,得到白色沉淀和无色溶液.过滤得到白色沉淀A,无色滤液B.
步骤二:向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解.
步骤三:向无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀;则该固体混合物中一定含有______,可能含有______;
步骤二中可能发生反应的化学方程式为______.
(2)现有一包化肥,可能是氯化钾、硝酸钾、氯化铵、硝酸铵中的一种,为确定其组成,进行如下实验(化肥中的杂质不参加反应):
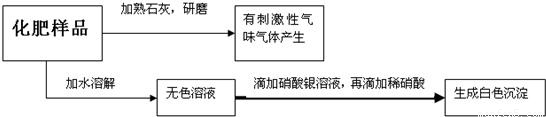
则该化肥是______(填化学式).
铜离子和铁离子的溶液有色,碳酸钡和硫酸钡不溶于水,但碳酸钡溶于盐酸.
(2)能和碱反应放出气体的物质含有铵根,能和硝酸酸化的硝酸银溶液反应产生沉淀的证明含有氯离子.
解答:解:(1)步骤一:得到无色溶液,排除CuSO4和FeCl3存在.
得到白色沉淀A,白色沉淀可能是碳酸钠和氯化钡反应生成的碳酸钡,也可能是硫酸钠溶液和氯化钡反应生成的硫酸钡,也可能二者都有,可以肯定氯化钡一定存在;
无色滤液B可以肯定氯化钡参加反应生成的氯化钠,原溶液中的KNO3和NaCl不能肯定.
步骤二:向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解,BaCO3+2HCl=BaCl2+H2O+CO2↑
说明碳酸钡和硫酸钡二者都存在,即原溶液中碳酸钠和硫酸钠一定存在.
步骤三:无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀,证明一定存在氯离子,但不能肯定是原溶液的氯化钠,因为氯化钡中也含有氯离子;
故答案为:BaCl2、Na2CO3、Na2SO4;KNO3、NaCl;
BaCO3+2HCl=BaCl2+H2O+CO2↑
(2)能和碱反应放出气体的物质含有铵根,能和硝酸酸化的硝酸银溶液反应产生沉淀的证明含有氯离子,所以肥料是NH4Cl
故答案为:NH4Cl
点评:这类题的解题方法或思路是:首先,分析好题意,既关注明显信息,又要挖掘出有用的隐含信息;然后,根据所学的掌握的基础知识,抓住关键信息,寻找突破口(即物质的特性或反应时的特殊现象等),细心地全面地思考、推断即可.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案根据表格回答:部分酸、碱和盐在水中的溶解性(20℃)
|
| OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | 不 |
| Zn2+ | 不 | 溶 | 溶 | 溶 | 不 |
| Fe3+ | 不 | 溶 | 溶 | 溶 | 不 |
(1)Ba(OH)2的溶解性为 ,从上表中找出一种微溶性盐 (填化学式)。
(2)Zn(NO3)2、CuCl2两种溶液 发生反应(填“能”或“不能”),
理由是 。
(3)现有一包白色固体混合物,可能由BaCl2、KNO3、CuSO4、FeCl3、Na2CO3、Na2SO4、NaCl等中的几种混合而成,为证明其组成,做如下实验:
步骤一:取一定量该固体混合物加入足量的水,充分搅拌,得到白色沉淀和无色溶液。过滤得到白色沉淀A,无色滤液B。
步骤二:向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解。
步骤三:向无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀;则该固
体混合物中一定含有 ,可能含有 ;
步骤二中发生反应的化学方程式为 。
根据表格回答:部分酸、碱和盐在水中的溶解性(20℃)
|
| OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | 不 |
| Zn2+ | 不 | 溶 | 溶 | 溶 | 不 |
| Fe3+ | 不 | 溶 | 溶 | 溶 | 不 |
(1)Ba(OH)2的溶解性为 ,从上表中找出一种微溶性盐 (填化学式)。
(2)Zn(NO3)2、CuCl2两种溶液 发生反应(填“能”或“不能”),
理由是 。
(3)现有一包白色固体混合物,可能由BaCl2、KNO3、CuSO4、FeCl3、Na2CO3、Na2SO4、NaCl等中的几种混合而成,为证明其组成,做如下实验:
步骤一:取一定量该固体混合物加入足量的水,充分搅拌,得到白色沉淀和无色溶液。过滤得到白色沉淀A,无色滤液B。
步骤二:向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解。
步骤三:向无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀;则该固
体混合物中一定含有 ,可能含有 ;
步骤二中发生反应的化学方程式为 。