题目内容
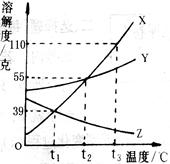
右图为X、Y、Z三种固体物质的溶解度曲线。回答下列问题:
(1) ① t30C时,X、Y、Z三种物质溶解度的大小关系 。
② t30C时,将等质量的X、Y、Z溶于水,都刚好形成饱和溶液则需加入水的质量由多到少的顺序是 。
(2)分别将X、Y、Z的饱和溶液从t30C降温到t10C时,三种溶液中溶质的质量分数由大到小的顺序是 。
X>Y>Z Z>Y>X Y>X>Z
解析试题分析:(1)①根据溶解度曲线图可知,t30C时,X的溶解度曲线在最上方,故最大;Z的溶解度曲线在最下方,故最小,因此三种物质溶解度的大小关系为X>Y>Z;
②由于t30C时,三种物质溶解度的大小关系为X>Y>Z,即t30C时,在每100g水中形成饱和溶液时,三种物质的溶质质量的大小关系为X>Y>Z,故若将等质量的X、Y、Z溶于水,都刚好形成饱和溶液则需加入水的质量由多到少的顺序是Z>Y>X;
(2)根据溶解度曲线可知:X的溶解度随温度的升高而逐渐增大,且变化较大;Y的溶解度随温度的升高也逐渐增大,但受温度的变化影响较小;而Z的溶解度随温度的升高而逐渐减小,故分别将X、Y、Z的饱和溶液从t30C降温到t10C时,X、Y均有溶质析出,故所得溶液仍为饱和溶液;Z则由于溶解度变大而变为不饱和溶液,但由于溶质、溶剂的质量都没变,故其溶质的质量分数不变。根据饱和溶液的溶质质量分数=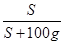 ×100%,结合t10C时Y的溶解度大于X的溶解度,故此温度下,Y的饱和溶液的溶质质量分数大于X;由于t10C时Z为不饱和溶液,故不能用此温度下的溶解度计算,但由于其溶质的质量分数不变,故可用其t30C时的饱和溶液的溶质质量分数代替, 而t30C时Z的溶解度更小,故溶质质量分数更小,所以三种溶液中溶质的质量分数由大到小的顺序是Y>X>Z。
×100%,结合t10C时Y的溶解度大于X的溶解度,故此温度下,Y的饱和溶液的溶质质量分数大于X;由于t10C时Z为不饱和溶液,故不能用此温度下的溶解度计算,但由于其溶质的质量分数不变,故可用其t30C时的饱和溶液的溶质质量分数代替, 而t30C时Z的溶解度更小,故溶质质量分数更小,所以三种溶液中溶质的质量分数由大到小的顺序是Y>X>Z。
考点:固体溶解度曲线及其作用,溶质质量分数的计算
点评:本题主要考查了固体溶解度曲线所表示的意义,及根据固体溶解度曲线来解决相关问题,注重培养学生的分析问题、解决问题的能力,解题的关键是要熟记和理解固体溶解度曲线及其应用。

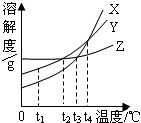
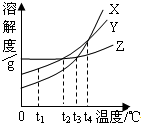
| A、在t1℃时,三种物质的溶解度大小顺序为:X>Y>Z | B、在t2℃时,X、Y的饱和溶液中溶质的质量分数相等 | C、在温度大于t2℃、小于t3℃时,三种物质的溶解度大小顺序为:Y>Z>X | D、相同质量的三种物质的饱和溶液,温度由t4℃冷却到t1℃时,析出晶体(不含结晶水)的质量大小顺序为:X>Z>Y |