题目内容
(2006?南通)请你参与某学习小组进行研究性学习的过程,并协助完成相关任务.研究课题:
探究热水壶底部水垢的主要成分
查阅资料:
该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐、碱等的混合物).同时,他们还查阅到下列有关物质的溶解性:
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
水垢的主要成分一定含有Mg(OH)2和,可能含有Ca(OH)2和.
设计方案:
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入,没有白色沉淀,说明水垢中无Ca(OH)2.
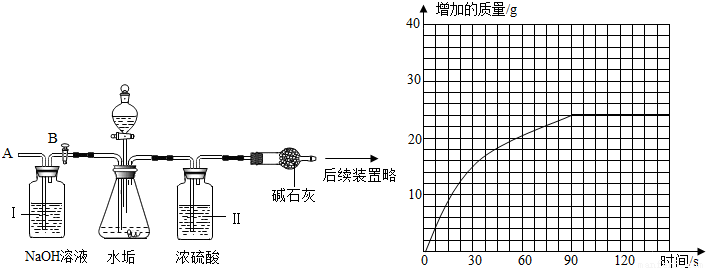
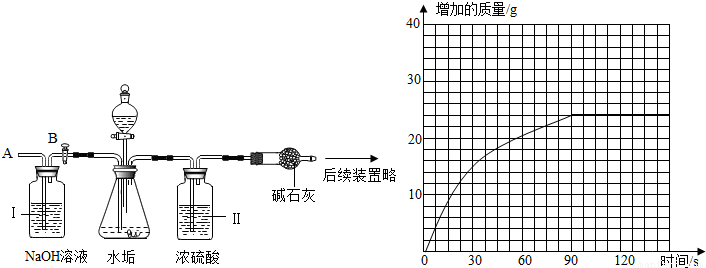
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分.其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变.
讨论:
a、步骤①加入样品前还应检查,所加的酸溶液是.
b、装置Ⅱ的作用是;从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是.
c、研究性小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是.
实验结论:通过上述探究可知:水垢的主要成分有.
【答案】分析:提出猜想:水垢主要成分为不溶性或微溶性的碳酸盐、碱等的混合物;结合溶解性表,分析表中不溶或微溶物,对水垢成分进行猜想;
设计方案:(1)利用氢氧化钙能与可溶性碳酸盐生成不溶性的碳酸钙沉淀,可采取滴加碳酸钠溶液的方法检验清液中是否含有氢氧化钙;
(2)可利用碳酸盐能与稀盐酸反应放出气体二氧化碳,通过干燥管内物质增加的质量测定水垢与足量稀盐酸充分反应后所放出二氧化碳的量,根据化学方程式进行计算,判断水垢中碳酸盐的组成;
实验结论:综合整个探究过程,得出水垢主要成分的结论.
解答:解:提出猜想:根据查阅到有关物质的溶解性表,氢氧化镁和碳酸钙不溶,而氢氧化钙和碳酸镁微溶,因此,猜想水垢中一定含有不溶的氢氧化镁和碳酸钙,可能含有微溶的氢氧化钙和碳酸镁;
故答案为:CaCO3;MgCO3;
设计方案:(1)为检验氢氧化钙,取上层清液加入碳酸钠溶液,无白色沉淀出现,说明所取上层清液中不含氢氧化钙;
故答案为:Na2CO3溶液;
(2)a、为防止实验过程中因装置漏气而造成结果错误,在进行实验前要对装置的气密性进行检验;利用碳酸盐可与稀盐酸完全反应放出二氧化碳,因此,所使用的酸应为稀动盐酸;
故答案为:装置的气密性;稀盐酸;
b、装置II中盛放的浓硫酸可以吸收生成的二氧化碳气体中混有的水,避免水对气体质量的测定产生影响;装置I中盛放的氢氧化钠溶液可除去空气中的二氧化碳,避免在鼓入空气时空气中的二氧化碳影响对反应生成二氧化碳质量测定;
故答案为:吸收CO2中的水;除去空气中的CO2;
c、干燥管内碱石灰因吸收二氧化碳而质量增加,干燥管增加的质量即为二氧化碳气体的质量;根据测量结果所得曲线,最终产生二氧化碳质量为24g;
假设50g水垢全部为碳酸钙或碳酸镁,完全反应放出二氧化碳的质量分别为x、y
CaCO3~CO2
100 44
50g x
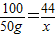 x=22g<24g,因此水垢不能全部为碳酸钙;
x=22g<24g,因此水垢不能全部为碳酸钙;
MgCO3~CO2
84 44
50g y
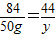 y≈26.2g>24g,因此水垢一定含有碳酸镁;
y≈26.2g>24g,因此水垢一定含有碳酸镁;
故答案为:即使50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量>22g;
实验结论:根据甲同学的实验,该水垢样品中一定不含氢氧化钙;根据乙同学的实验探究,该水垢样品中一定含碳酸镁;因此,水垢的主要成分应为氢氧化镁、碳酸钙和碳酸镁的混合物;
故答案为:Mg(OH)2、CaCO3、MgCO3.
点评:根据装置的特点及装置中所盛放药品的性质,对装置的作用进行理解,是解决给出实验装置类探究问题的一个重要手段.
设计方案:(1)利用氢氧化钙能与可溶性碳酸盐生成不溶性的碳酸钙沉淀,可采取滴加碳酸钠溶液的方法检验清液中是否含有氢氧化钙;
(2)可利用碳酸盐能与稀盐酸反应放出气体二氧化碳,通过干燥管内物质增加的质量测定水垢与足量稀盐酸充分反应后所放出二氧化碳的量,根据化学方程式进行计算,判断水垢中碳酸盐的组成;
实验结论:综合整个探究过程,得出水垢主要成分的结论.
解答:解:提出猜想:根据查阅到有关物质的溶解性表,氢氧化镁和碳酸钙不溶,而氢氧化钙和碳酸镁微溶,因此,猜想水垢中一定含有不溶的氢氧化镁和碳酸钙,可能含有微溶的氢氧化钙和碳酸镁;
故答案为:CaCO3;MgCO3;
设计方案:(1)为检验氢氧化钙,取上层清液加入碳酸钠溶液,无白色沉淀出现,说明所取上层清液中不含氢氧化钙;
故答案为:Na2CO3溶液;
(2)a、为防止实验过程中因装置漏气而造成结果错误,在进行实验前要对装置的气密性进行检验;利用碳酸盐可与稀盐酸完全反应放出二氧化碳,因此,所使用的酸应为稀动盐酸;
故答案为:装置的气密性;稀盐酸;
b、装置II中盛放的浓硫酸可以吸收生成的二氧化碳气体中混有的水,避免水对气体质量的测定产生影响;装置I中盛放的氢氧化钠溶液可除去空气中的二氧化碳,避免在鼓入空气时空气中的二氧化碳影响对反应生成二氧化碳质量测定;
故答案为:吸收CO2中的水;除去空气中的CO2;
c、干燥管内碱石灰因吸收二氧化碳而质量增加,干燥管增加的质量即为二氧化碳气体的质量;根据测量结果所得曲线,最终产生二氧化碳质量为24g;
假设50g水垢全部为碳酸钙或碳酸镁,完全反应放出二氧化碳的质量分别为x、y
CaCO3~CO2
100 44
50g x
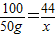 x=22g<24g,因此水垢不能全部为碳酸钙;
x=22g<24g,因此水垢不能全部为碳酸钙;MgCO3~CO2
84 44
50g y
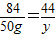 y≈26.2g>24g,因此水垢一定含有碳酸镁;
y≈26.2g>24g,因此水垢一定含有碳酸镁;故答案为:即使50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量>22g;
实验结论:根据甲同学的实验,该水垢样品中一定不含氢氧化钙;根据乙同学的实验探究,该水垢样品中一定含碳酸镁;因此,水垢的主要成分应为氢氧化镁、碳酸钙和碳酸镁的混合物;
故答案为:Mg(OH)2、CaCO3、MgCO3.
点评:根据装置的特点及装置中所盛放药品的性质,对装置的作用进行理解,是解决给出实验装置类探究问题的一个重要手段.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
(2006?南通)请你参与某学习小组进行研究性学习的过程,并协助完成相关任务.
研究课题:
探究热水壶底部水垢的主要成分
查阅资料:
该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐、碱等的混合物).同时,他们还查阅到下列有关物质的溶解性:
提出猜想:
水垢的主要成分一定含有Mg(OH)2和,可能含有Ca(OH)2和.
设计方案:
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入,没有白色沉淀,说明水垢中无Ca(OH)2.
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分.其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变.
讨论:
a、步骤①加入样品前还应检查,所加的酸溶液是.
b、装置Ⅱ的作用是;从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是.
c、研究性小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是.
实验结论:通过上述探究可知:水垢的主要成分有.
研究课题:
探究热水壶底部水垢的主要成分
查阅资料:
该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐、碱等的混合物).同时,他们还查阅到下列有关物质的溶解性:
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
水垢的主要成分一定含有Mg(OH)2和,可能含有Ca(OH)2和.
设计方案:
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入,没有白色沉淀,说明水垢中无Ca(OH)2.
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分.其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变.

讨论:
a、步骤①加入样品前还应检查,所加的酸溶液是.
b、装置Ⅱ的作用是;从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是.
c、研究性小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是.
实验结论:通过上述探究可知:水垢的主要成分有.
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O