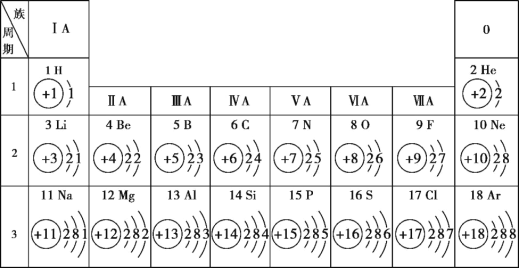
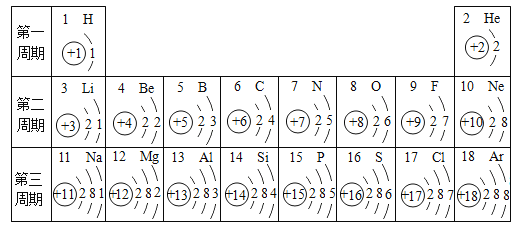
��Ŀ����
����Ŀ����ͭ��ͭ��п�ĺϽ�Cu��Zn����������������������������Ʒ��Ϊ�˲ⶨij��ͭ��Ʒ��п�����������������ǻ�ͭ�е��������ʣ����ֽ�15mLϡ��������μ��뵽10g��ͭ��Ʒ��ĩ�У�ÿ�γ�ַ�Ӧ�ⶨ����������������ʵ�����ݼ������Իش��������⣺
��һ�� | �ڶ��� | ������ | |
����ϡ����������mL�� | 5 | 5 | 5 |
����������������g�� | 0.04 | m | 0.02 |
��1��д����Ӧ�Ļ�ѧ����ʽ______��
��2��m=______��
��3���г���һ�η�Ӧ�вμӷ�Ӧ��п��������x���ı���ʽ��______��
��4���˻�ͭ��Ʒ��п������������______��
��5������ҵ���ú�Cu2S80%�Ļ�ͭ��135t�����ƹ����л�ͭ�����ʧ��Ϊ20%����������������ͭ������Ϊ______��
���𰸡�![]() 0.04
0.04 ![]() 32.5% 102.4t
32.5% 102.4t
��������
п��ϡ���ᷴӦ��������п��������
��1��п��ϡ���ᷴӦ��������п����������Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��2���ɱ��е����ݿ�֪��5mLϡ������ȫ��п��Ӧ����0.04g����������Ϊ�����μ���ϡ����ʱ������0.02g���������Եڶ��μ����5mLϡ������ȫ��Ӧ������������������0.04g����m=0.04��
��3�����һ�η�Ӧ��п������Ϊx
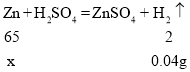
![]()
��4����п������Ϊy��
п��ȫ��Ӧʱ��������������Ϊ![]()
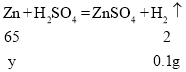
![]()
![]()
�˻�ͭ��Ʒ��п����������Ϊ![]()
��5���ú�Cu2S80%�Ļ�ͭ��135t�����ƹ����л�ͭ�����ʧ��Ϊ20%����������ͭ������Ϊ135t����1��20%����80%��![]() ��100%=69.12t�������������Ƴ���ͭ������Ϊ69.12t��(1��32.5%)=102.4t��
��100%=69.12t�������������Ƴ���ͭ������Ϊ69.12t��(1��32.5%)=102.4t��

 ��У����ϵ�д�
��У����ϵ�д�