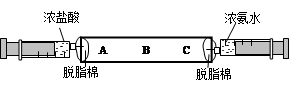��Ŀ����
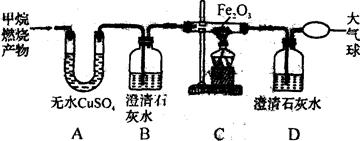
����ͬѧ�ڻ�ѧʵ���ҷ���һƿʢ����ɫ��Һ���Լ�ƿ�����ǩ����������ͼ��ʾ������ʦ����������ƿ�Լ����������ᡢ�����ơ�����ͭ������þ��Һ�е�һ�֣�[��������]���������������ʵ��ܽ�����±���
��1������������Ϣ�����ų� �� ��Һ��
��2��Ϊȷ����ɷ�����ͬѧ�Դ���Һ��������ʵ��̽����
[��������]����Һ������ ��Һ��
[ʵ����֤]

| ���� | H2SO4 | Na2SO4 | MgSO4 | CuSO4 |
| �ܽ��/g | ��ˮ����Ȼ��� | 19.0 | 39.0 | 23.1 |
��2��Ϊȷ����ɷ�����ͬѧ�Դ���Һ��������ʵ��̽����
[��������]����Һ������ ��Һ��
[ʵ����֤]
| ʵ�鷽�������� | ���ܳ��ֵ����� | ���ۻ��йػ�ѧ����ʽ |
| | | |
1�������ƺ�����ͭ��Һ��2������þ�������ᣩ
| ʵ�鷽�������� | ���ܳ��ֵ����� | ���ۻ��йػ�ѧ����ʽ |
| ��һֻ�Թ�װ��������Һ��������������Һ | ������ɫ���� | ����ҺΪMgSO4�� MgSO4+2NaOH=Mg��OH��2��+Na2SO4 |
�����������1��������ܽ��������ˮ������Ȼ��ܣ���Һ�����ʵ������������Դﵽ20%��������������������Ƶ��ܽ�ȣ��ڸ��¶��£������Ʊ�����Һ�����ʵ���������Ϊ��
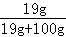 ��100%��17%������������������ᳬ��17%����ͼ����ϢΪ20%����һ��������������Һ����������þ���ܽ�ȣ��ڸ��¶��£�����þ������Һ�����ʵ����������ǣ�
��100%��17%������������������ᳬ��17%����ͼ����ϢΪ20%����һ��������������Һ����������þ���ܽ�ȣ��ڸ��¶��£�����þ������Һ�����ʵ����������ǣ�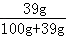 ��100%��28.06%������������������ᳬ��28.06%������������þ����������ͭ���ܽ�ȣ��ڸ��¶��£�����ͭ������Һ�����ʵ���������Ϊ��
��100%��28.06%������������������ᳬ��28.06%������������þ����������ͭ���ܽ�ȣ��ڸ��¶��£�����ͭ������Һ�����ʵ���������Ϊ��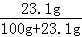 ��100%��18.8%������������������ᳬ��18.8%����ͼ����ϢΪ20%����һ����������ͭ��Һ����2���ɸ������������þ���������ʵ�鷽��������þ�����������Ʒ�Ӧ����������þ��ɫ������
��100%��18.8%������������������ᳬ��18.8%����ͼ����ϢΪ20%����һ����������ͭ��Һ����2���ɸ������������þ���������ʵ�鷽��������þ�����������Ʒ�Ӧ����������þ��ɫ������
��ϰ��ϵ�д�
�����Ŀ