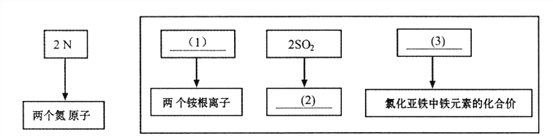
��Ŀ����
����Ŀ�����õ�ͭ��Ʒ������������ɫ��ͭ��[��Ҫ�ɷ�ΪCu2��OH��2CO3]��ij��ȤС������ʴ���صķ�ͭмΪԭ�ϣ�������ȡ��ͭ����ͼ�Ǹ���ȤС����Ƶ����ֻ��չ���ʵ�鷽�����ش����⣺

�������ϣ�Cu2��OH��2CO3+2H2SO4��2CuSO4+3H2O+CO2����
Cu2��OH��2CO3![]() 2CuO+H2O+CO2��
2CuO+H2O+CO2��
��1�����������з�����Ӧ�Ļ�ѧ����ʽ_____��
��2���������V����Ҫ���е�ʵ�������_____��
��3������V���̷�����Ӧ�Ļ�ѧ����ʽΪ_____��
��4�������ַ�����ȡ��ͬ������ͭ�����ķ�ͭм������������һ_____������������������������������������ַ����У���������Խ�ڷ���һ����������_____����_____���δ����㣩��
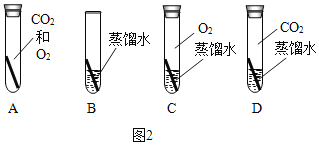
��5������ͭ�����Ҫ�ɷ֣������жϳ�ͭ������Ҫ�����е�_____����Ҫ̽����ͭ�����Ƿ���Ҫ�����е�����������ͼ2��ʾʵ���У�ֻ�����_____������ĸ��ʵ�鼴�ɴﵽʵ��Ŀ�ġ�
���𰸡�CuO+CO![]() Cu+CO2 ���� Fe+H2SO4��FeSO4+H2�� �� ��Լ��Դ ����ȫ ˮ��������̼������ BD
Cu+CO2 ���� Fe+H2SO4��FeSO4+H2�� �� ��Լ��Դ ����ȫ ˮ��������̼������ BD
��������
��������������ͭ��һ����̼��Ӧ����ͭ�Ͷ�����̼�������ܹ���ȥ������ˮ�����ʣ�����ϡ���ᷴӦ������������������������ʵ����������ж�ʵ����ۡ�
��1����������������ͭ��һ����̼��Ӧ����ͭ�Ͷ�����̼��������Ӧ�Ļ�ѧ����ʽΪ��CuO+CO![]() Cu+CO2��
Cu+CO2��
��2���������V����Ҫ���е�ʵ������ǹ��ˣ��Գ�ȥ������ˮ�����ʣ�
��3������V����������ϡ���ᷴӦ��������������������������Ӧ�Ļ�ѧ����ʽΪ��Fe+H2SO4��FeSO4+H2����
��4����ͭм�е�ͭԪ����ȫת����ͭ�У������ַ�����ȡ��ͬ������ͭ�����ķ�ͭм������������һ�����������������ַ����У���������Խ�ڷ���һ�������ǽ�Լ��Դ������ȫ���������ȣ�
��5������ͭ�����Ҫ�ɷֿ�֪����̼Ԫ�ء���Ԫ�ء���Ԫ�غ�ͭԪ�أ������жϳ�ͭ������Ҫ�����е�ˮ��������̼����������Ҫ̽����ͭ�����Ƿ���Ҫ�����е�����������ͼ2��ʾʵ���У�ֻ�����BDʵ�鼴�ɴﵽʵ��Ŀ�ģ�������ΪD�к��ж�����̼��ˮ����ͭ�������⣬B�к���ˮ������������̼��������ͭ�ܹ����⣬˵��ͭ������Ҫ������

 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�����Ŀ��Ŀǰ�ֳ��о�����ʹ�õ�ȼ����Ҫ�ǹܵ�ú������Ȼ�����ܵ�ú������Ҫ�ɷ���CO��H2���������࣬��Ȼ������Ҫ�ɷ���CH4�����ǵ�ȼ�շ�Ӧ���£�
2CO+O2![]() 2CO2��2H2+O2
2CO2��2H2+O2![]() 2H2O ��CH4+2O2
2H2O ��CH4+2O2![]() CO2+2H2O
CO2+2H2O
��1���������ϻ�ѧ����ʽ�жϣ���ͬ�����£�ȼ����ͬ����Ĺܵ�ú������Ȼ�������Ŀ�������ϴ����__________�����ȼ�չܵ�ú����������������Ȼ������ߵĸĽ�������______����ڣ������С�������粻�Ľ����ܲ����IJ��������___________��
��2����ͥú���ܳ���Ӳ�ʾ�����ϩ�;���ϩ���Ϲܣ����Ϲ�����_______���ϡ�
��3���ܵ�ú���к��е����࣬����������������顢���顢����ȵ�ijЩ���ʼ��±���
���� | ���� | ���� | |
�۵�/�� | -183.3 | -189.7 | -183.4 |
�е�/�� | -88.6 | -42.1 | -0.5 |
�Ը�������ij���ؼ����ݽ��Ͷ����Ϻ�������ʱ�ܵ�ú�������С�����ҳʶ���״̬��ԭ���ǣ�________________��