题目内容
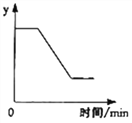
【题目】向一定量硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉的质量关系如图所示。
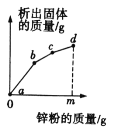
(1)c点对应的溶液中含有哪些金属离子______?
(2)写出ab段(不含两端点)反应的化学方程式_______。
(3)若bc段和cd段中析出固体的质量相等,相应阶段参加反应的锌粉的质量分别为m1和m2 ,则m1与m2的大小关系是什么______?为什么________?
【答案】Zn2+和Fe2+ Zn +2AgNO3 == 2Ag+ Zn(NO3)2 m1<m2 因为每65份质量的锌完全反应置换出64份质量的铜,置换出56份质量的铁。
【解析】
向一定量硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,锌先与硝酸银反应生成硝酸锌和银,后与硝酸铜反应生成铜和硝酸锌,然后与硝酸亚铁反应生成硝酸锌和铁。(1)c点硝酸银和硝酸铜完全反应,银离子和铜离子都转化成锌离子,对应的溶液中含有的金属离子为锌离子和亚铁离子;
(2)ab段(不含两端点)发生的反应是硝酸银反应和锌生成硝酸锌和银,化学方程式Zn+2AgNO3=2Ag+Zn(NO3)2;
(3)若bc段是硝酸铜和锌反应,cd段是硝酸亚铁和锌反应,析出固体的质量相等即生成的铁和和铜的质量相同,相应阶段参加反应的锌粉的质量分别为m1和m2,
设生成铜的质量为x

65/m1=64/xm1=65x/64
设生成铁的质量为x
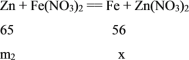
65/m2=56/xm2=65x/56
则m1与m2的大小关系是m1<m2

练习册系列答案
相关题目