题目内容
某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。他们分别用100g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。请回答下列问题:
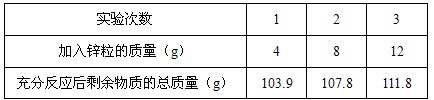
(1)第_______次实验,锌粒与稀硫酸恰好完全反应。
(2)计算稀硫酸的质量分数(写出计算过程)。
(2)计算稀硫酸的质量分数(写出计算过程)。
解:(1)2
(2)用恰好完全反应的第2次实验数据进行计算。
8克锌粒完全反应生成氢气的质量是100g+8g-107.8g = 0.2g
设生成0.2g氢气需H2SO4的质量为x
Zn+H2SO4==ZnSO4+H2↑
98 2
x 0.2g
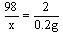 ;x=9.8g
;x=9.8g
该稀硫酸的质量分数为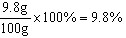
(2)用恰好完全反应的第2次实验数据进行计算。
8克锌粒完全反应生成氢气的质量是100g+8g-107.8g = 0.2g
设生成0.2g氢气需H2SO4的质量为x
Zn+H2SO4==ZnSO4+H2↑
98 2
x 0.2g
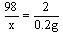 ;x=9.8g
;x=9.8g该稀硫酸的质量分数为
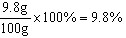

练习册系列答案
相关题目
某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析.他们分别用100g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表.
请回答下列问题:
(1)第 次实验,锌粒与稀硫酸恰好完全反应.
(2)计算稀硫酸的质量分数(写出计算过程).
| 实验次数 | 1 | 2 | 3 |
| 加入锌粒的质量(g) | 4 | 8 | 12 |
| 充分反应后剩余物质的总质量(g) | 103.9 | 107.8 | 111.8 |
(1)第
(2)计算稀硫酸的质量分数(写出计算过程).
某课外兴趣小组对一批钢铁样品(杂质不溶于水,也不与稀硫酸反应)进行分析.甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与钢铁样品恰好完全反应.实验数据如下:
(1)哪位同学所取用的稀硫酸与钢铁样品恰好完全反应;
(2)计算样品中铁的质量分数;
(3)计算恰好完全反应后所得溶液中溶质的质量分数.(说明:其中烧杯的质量为50.8g,计算结果精确到0.1%)
| 实验操作数据及结果 | 甲 | 乙 | 丙 |
| 烧杯+稀硫酸 | 400g | 300g | 300g |
| 加入钢铁样品 | 18g | 18g | 28g |
| 充分反应后:烧杯+剩余物 | 417.4g | 317.4g | 327.4g |
(2)计算样品中铁的质量分数;
(3)计算恰好完全反应后所得溶液中溶质的质量分数.(说明:其中烧杯的质量为50.8g,计算结果精确到0.1%)
 19、某课外兴趣小组用实验的方法对蜡烛火焰的焰心进行了以下探究.
19、某课外兴趣小组用实验的方法对蜡烛火焰的焰心进行了以下探究.