题目内容
【题目】某炼铁厂用赤铁矿石炼铁(除氧化铁外,其他成分不溶于水,也不与酸反应),现要测定该赤铁矿中氧化铁的含量,进行如下实验:

(1)写出上述发生反应的化学方程式_____;
(2)列出求解20g赤铁矿石中氧化铁质量(x)的比例式_____;
(3)此赤铁矿中氧化铁的质量分数为_____;
(4)向反应后所得溶液中加入46.5g水,则最终溶液中溶质的质量分数为_____;
(5)若用配制100g 21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为_____g;配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有_____。
【答案】Fe2O3+6HCl═2FeCl3+3H2O; ![]() 或者
或者![]() ; 80%; 100%; 60g; 玻璃棒、胶头滴管。
; 80%; 100%; 60g; 玻璃棒、胶头滴管。
【解析】
该过程发生反应是氧化铁和盐酸反应生成氯化铁和水,对应的化学方程式 Fe2O3+6HCl═2FeCl3+3H2O;
设20g赤铁矿石中氧化铁质量为x,生成的氯化铁的质量为y
消耗的HCl的质量为100g×21.9%=21.9g
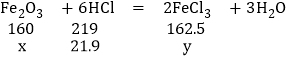
![]()
x=16g
y=16.25g
此赤铁矿中氧化铁的质量分数为![]() ×100%=80%;
×100%=80%;
向反应后所得溶液中加入46.5g水,则最终溶液中溶质的质量分数为 ![]() =10%;
=10%;
(5)若用配制100g 21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为![]() =60g;配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有 玻璃棒、胶头滴管。
=60g;配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有 玻璃棒、胶头滴管。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
【题目】从微观角度探析宏观的变化是化学学习的特点之一,请据表回答:
甲 | 乙 |
实验一:水沸腾实验二:水的分解 |
|
(1)乙中的微观过程对应甲中的实验______(选填“一”或“二”);
(2)请你将乙中的B图缺少的粒子补全______;
(3)在此变化中不发生改变的粒子是______。