题目内容
将一定量的CO2气体通入NaOH溶液中,恰好完全反应,测得反应后溶液的质量为44.4g,若把溶液蒸干可得到无水Na2CO310.6g.求NaOH溶液中溶质的质量分数.
分析:根据二氧化碳与氢氧化钠反应的化学方程式,由碳酸钠的质量计算出氢氧化钠和二氧化碳的质量,最后计算氢氧化钠溶液的质量分数.
解答:解:设氢氧化钠的质量为X,二氧化碳的质量是Y.
2NaOH+CO2═Na2CO3+H2O
80 44 106
X Y 10.6克
=
=
解得:X=8g Y=4.4g
∴根据质量守恒定律可知,原NaOH溶液的质量=44.4g-4.4g=40g.
∴原NaOH溶液的质量分数=
×100%═20%.
答:原NaOH溶液的质量分数为20%.
2NaOH+CO2═Na2CO3+H2O
80 44 106
X Y 10.6克
| 80 |
| X |
| 44 |
| Y |
| 106 |
| 10.6g |
解得:X=8g Y=4.4g
∴根据质量守恒定律可知,原NaOH溶液的质量=44.4g-4.4g=40g.
∴原NaOH溶液的质量分数=
| 8g |
| 40g |
答:原NaOH溶液的质量分数为20%.
点评:掌握化学方程式的计算格式和规范性,注意:原NaOH溶液质量的计算.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
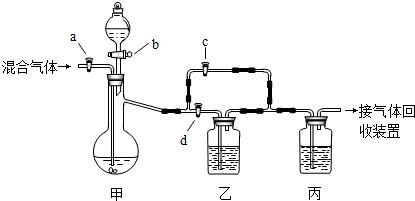
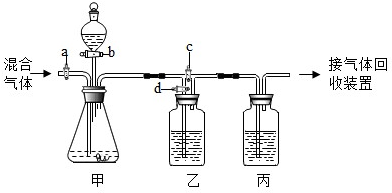 (2012?房山区一模)用如图的装置将一定量的CO2和CO的混合气体进行分离和干燥.图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭.请选择适宜的试剂完成上述实验.供选用的试剂有:①稀硫酸②浓硫酸③氢氧化钠溶液④澄清的石灰水(试剂均足量)
(2012?房山区一模)用如图的装置将一定量的CO2和CO的混合气体进行分离和干燥.图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭.请选择适宜的试剂完成上述实验.供选用的试剂有:①稀硫酸②浓硫酸③氢氧化钠溶液④澄清的石灰水(试剂均足量)