题目内容
我国兰州的近代物理研究所曾经研究制出首批重氧气(O2)(其相对原子质量为18,其质子数为8),其价格远远超过黄金。则下列说法正确的是
A.重氧气的相对分子质量为32 B.重氧气中氧原子的结构示意图为
C.重氧气中氧元素的化合价为-2 C.重氧气是一种化合物
A.重氧气的相对分子质量为32 B.重氧气中氧原子的结构示意图为

C.重氧气中氧元素的化合价为-2 C.重氧气是一种化合物
B
试题分析:A。由于重氧的相对原子质量为18,所以重氧气的相对分子质量为36,故A错。
B.由于氧原子的核内质子数为8,所以重氧原子的质子数也是8,其核外电子数也是8,而中子数为10,故B正确。
C.重氧气属于单质,单质中元素的化合价为0,故C错。
D.由于重氧气只含有一种元素,所以是一种单质,而不是化合物,故D错。
点评:对于此类试题,学生应掌握在原子中质子数=核电荷数=核外电子数。

练习册系列答案
相关题目
 分别表示两种元素的原子,仔细观察下图,回答下列问题:
分别表示两种元素的原子,仔细观察下图,回答下列问题:

 、
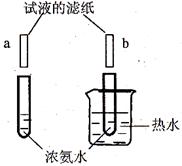
、 两片滴有无色酚酞试液的滤纸分别放在装有浓氨水的两只试管的上方,片刻后看到
两片滴有无色酚酞试液的滤纸分别放在装有浓氨水的两只试管的上方,片刻后看到