题目内容
【题目】(1)如图是元素周期表的一部分,请回答:
H | He | ||||||
O | F | ||||||
Na | Mg | Al | Si | S | Cl | ||
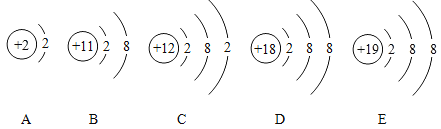
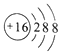
①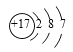 表示表中氯原子结构示意图,该原子易_____(填“得”或“失”)电子,形成的离子符号为_____。
表示表中氯原子结构示意图,该原子易_____(填“得”或“失”)电子,形成的离子符号为_____。
②表中元素铝和氧形成常见化合物的化学式为_____。
(2)胃酸过多可服用抗酸药铝碳酸镁片(AlMg(OH)3CO3)。铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2↑。铝碳酸镁起抗酸作用的两种微粒是_____、_____。
【答案】得 Cl Al2O3 OH CO32
【解析】
(1)①根据原子结构示意图的意义以及离子符号的写法来分析;
②根据元素种类,结合其常显化合价来书写化学式;
(2)根据酸、碱、盐之间的反应、氢离子与碳酸根离子反应等方面进行分析。
(1)①由原子结构示意图可知,这是17号元素氯原子的结构示意图,其最外层有7个电子,在化学反应中易得到1个电子,而形成带一个单位负电荷的氯离子;故填:得; Cl。
②是氧元素,在化合物中常显2价,铝元素常显+3价;二者组成的化合物氧化铝的化学式为Al2O3;故填:Al2O3;
(2)根据铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑,故AlMg(OH)3CO3中的两种微粒OH、CO32都能中和胃酸中的氢离子。故填:OH、CO32。

练习册系列答案
相关题目