题目内容
【题目】回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下。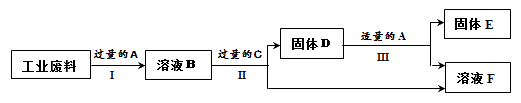
已知: CuO + H2SO4=CuSO4 + H2O Fe + Fe2(SO4) 3=3FeSO4
(1)过程Ⅰ中氧化铁发生反应的化学方程式是。
(2)过程Ⅱ充分反应后,还应有的实验操作是。
(3)过程Ⅲ的实验现象是。
【答案】
(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(2)过滤
(3)有气泡产生,溶液由无色变为浅绿色
【解析】(1)过程Ⅰ中,要最终得到硫酸亚铁,则溶解氧化铜和氧化铁使用的酸是稀硫酸,氧化铁能与稀硫酸反应生成硫酸铁和水;
(2)过程Ⅱ充分反应后,要得到固体和溶液,需要经过过滤操作;
(3)过程Ⅲ中,铁与硫酸反应生成硫酸亚铁和氢气,硫酸亚铁的溶液是浅绿色的;
所以答案是:(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;(2)过滤;(3)有气泡产生,溶液由无色变为浅绿色.
【考点精析】本题主要考查了过滤操作的注意事项和金属材料的选择依据的相关知识点,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属才能正确解答此题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
